
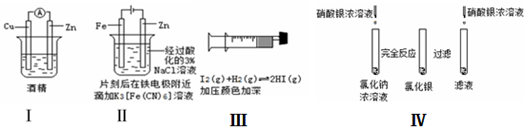
| A. | 方案Ⅰ验证金属活泼性:Zn>Cu | |
| B. | 方案Ⅱ验证Fe电极被保护 | |
| C. | 方案Ⅲ验证平衡移动原理 | |
| D. | 方案Ⅳ验证氯化银在水中存在溶解平衡 |
分析 A.酒精为非电解质;
B.Fe与电源正极相连,为阳极;
C.该反应为气体子总物质的量不变的反应,改变压强,平衡不移动;
D.滤液中加硝酸银生成白色沉淀,可说明AgCl溶解平衡的存在.
解答 解:A.酒精为非电解质,不能构成原电池,故A错误;
B.Fe与电源正极相连,为阳极,失去电子,加快Fe的腐蚀,故B错误;
C.该反应为气体子总物质的量不变的反应,改变压强,平衡不移动,不能验证平衡移动,故C错误;
D.完全反应后,过滤,取滤液中加硝酸银生成白色沉淀,可说明AgCl溶解平衡的存在,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握原电池、电解池、化学平衡移动、溶解平衡为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子序数关系是C>B>A | B. | 粒子半径关系是Bn-<An+ | ||
| C. | C一定是稀有气体元素的一种原子 | D. | 原子半径关系是A<B. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性高锰钾溶液的紫色褪去 | |
| B. | 乙烯与水在一定条件下反应生成乙醇 | |
| C. | 苯与浓硫酸和浓硝酸的混合溶液反应生成油状物 | |
| D. | 乙醇在催化剂存在的条件下与氧气反应生成乙醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是指单位时间内任何一种反应物物质的量的浓度的减少或任何一种生成物的物质的量的浓度的增加 | |
| B. | 化学反应速率为1.0 mol•L-1•s-1,是指在1 s时某物质的浓度是1.0 mol•L-1 | |
| C. | 化学反应速率可以衡量化学反应进行的快慢 | |
| D. | 对于任何化学反应来说,反应速率越快,反应现象不一定越明显 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 化合物3的分子式为C9H8O5 | |
| B. | 将等物质的量的化合物1、2、3、4分别与足量NaOH溶液反应,消耗NaOH的物质的量之比为1:3:2:1 | |
| C. | 愈创木酚能与Na2CO3溶液反应生成CO2 | |
| D. | 化合物2可以发生氧化反应、还原反应、取代反应、缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加铝粉产生H2的溶液:Fe2+、K+、Cl-、NO3- | |
| B. | 能使紫色石蕊试液变蓝的溶液:Na+、S2-、SiO32-、SO42- | |
| C. | 由水电离出的c(H+)=1×10-12 mol/L的溶液:Ca2+、HCO3-、Br-、S2- | |
| D. | 遇KSCN变红色的溶液:NH4+、AlO2-、I-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作、现象 | 得出的结论 | |
| A | 向一未知溶液的样品中,加入盐酸酸化的氯化钡溶液,生成大量白色沉淀 | 该溶液中一定含有SO42- |
| B | 向2.0mL浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1AgNO3溶液,振荡,沉淀呈黄色 | Ksp:AgCl>AgI |
| C | 取少量蔗糖溶液,加入3~5滴稀硫酸,水浴加热后再加入少量新制的Cu(OH)2悬浊液,加热3~5分钟,无砖红色沉淀生成 | 蔗糖没有水解 |
| D | 向两支装有2mL 0.1mol•L-1草酸溶液的试管中,分别滴入4mL 0.01mol•L-1的高锰酸钾溶液、4mL 0.02mol•L-1的高锰酸钾溶液,发现加4mL 0.02mol•L-1的高锰酸钾溶液的试管先褪色 | 浓度越大,反应速率越快 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲中沉淀一定比乙多 | B. | 甲和乙中沉淀可能一样多 | ||
| C. | 甲中沉淀可能比乙多 | D. | 乙中沉淀一定比甲多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向 100mL0.01mol•L-1HA 溶液中逐滴加入0.02mol•L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述一定正确的是( )
常温下,向 100mL0.01mol•L-1HA 溶液中逐滴加入0.02mol•L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述一定正确的是( )| A. | 由图中信息可知HA为弱酸 | |
| B. | 在N点pH=7,酸碱恰好完全反应 | |
| C. | 常温时一定浓度的MA稀溶液显中性 | |
| D. | K 点对应的溶液中,c(M+)+c(MOH)=2c (A-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com