
【题目】NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。已知:
反应I :4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1
反应 II : 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1
写出NO分解生成N2与O2的热化学方程式_____。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应I ,测得不同时间的NH3和O2,的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
c(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
c(O2)/mol L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述中正确的是_____________。
A.使用催化剂时,可降低该反应的活化能,加快其反应速率
B.若测得容器内4v正(NH3) =6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均速率v( NO)=0.088 mol·L-1·min-1
(3)氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1 mol NH3和2mol O2,测得有关物质的量关系如下图:

①该催化剂在低温时选择反应_______(填“ I ”或“ II”)。
② 52℃时,4NH3+3O2![]() 2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
2N2+6H2O的平衡常数K=_______(不要求得出计算结果,只需列出数字计算式)。
③ C点比B点所产生的NO的物质的量少的主要原因________。
(4)制备催化剂时常产生一定的废液,工业上常利用氢硫酸检测和除去废液中的Cu2+。
已知:25℃时,K1(H2S) =1.3×10-7,K1(H2S) =7.1×10-15,Ksp(CuS) =8.5×10-45
①在计算溶液中的离子浓度时,涉及弱酸的电离通常要进行近似处理。则0.lmol L-1氢
硫酸的pH≈______(取近似整数)。
②某同学通过近似计算发现0.lmol L-1氢硫酸与0.0lmol L-1氢硫酸中的c(S2-)相等,而且等于_____mol·L-1
③已知,某废液接近于中性,若加入适量的氢硫酸,当废液中c(Cu2+) >_____ mol·L-1(计算结果保留两位有效数字),就会产生CuS沉淀。
【答案】⑴2NO(g)![]() N2(g) +O2(g) △H= -180.8 kJ·mol-1
N2(g) +O2(g) △H= -180.8 kJ·mol-1
⑵AD
⑶①II ② ![]() ③该反应为放热反应,当温度升高,平衡向左(逆反应)移动
③该反应为放热反应,当温度升高,平衡向左(逆反应)移动
⑷① 4 ②7.1×10-15 ③1.2×10-30
【解析】(1)已知:反应I :4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1,反应 II : 4NH3(g)+3O2(g)
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1,反应 II : 4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1,根据盖斯定律可知( II-I)÷2可得2NO(g) =O2+N2(g) ,△H=[(-1266.6 kJ·mol-1)-(-905.0 kJ·mol-1)]÷2 = △H= -180.8 kJ·mol-1,NO分解生成N2与O2的热化学方程式为2NO(g)
2N2(g) +6H2O(g) △H= -1266.6 kJ·mol-1,根据盖斯定律可知( II-I)÷2可得2NO(g) =O2+N2(g) ,△H=[(-1266.6 kJ·mol-1)-(-905.0 kJ·mol-1)]÷2 = △H= -180.8 kJ·mol-1,NO分解生成N2与O2的热化学方程式为2NO(g)![]() N2(g) +O2(g) △H= -180.8 kJ·mol-1;
N2(g) +O2(g) △H= -180.8 kJ·mol-1;
(2)A.催化剂的使用,可降低该反应的活化能,加快其反应速率,故A正确;B.当6v正(NH3) =4v逆(H2O)时可说明反应已达平衡,故B错误;C.容器内![]() =1时,无法表明反应达到平衡,故C错误;D.前10分钟内的平均速率v(NH3)=v( NO)=
=1时,无法表明反应达到平衡,故C错误;D.前10分钟内的平均速率v(NH3)=v( NO)=![]() mol·L-1·min-1=0.088 mol·L-1·min-1,故D正确;答案为AD。
mol·L-1·min-1=0.088 mol·L-1·min-1,故D正确;答案为AD。
(3)①由图示可知低温时,容器主要产物为N2,则该催化剂在低温时选择进行反应II;
② 4NH3(g) +5O2(g)![]() 4NO(g) +6H2O
4NO(g) +6H2O
变化物质的量浓度(mol/L) 0.2 0.25 0.2 0.3
4NH3+3O2![]() 2N2+6H2O
2N2+6H2O
变化物质的量浓度(mol/L) 0.4 0.3 0.2 0.6
平衡物质的量浓度(mol/L) 0.4 1.45 0.2 0.9
故520℃时4NH3+3O2![]() 2N2+6H2O的平衡常数K=
2N2+6H2O的平衡常数K=![]() ;
;
③ 已知4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1,正反应是放热反应,当反应达到平衡后,温度升高,平衡向左(逆反应)移动,导致NO的物质的量逐渐减小,即C点比B点所产生的NO的物质的量少;
4NO(g) +6H2O(g) △H= -905.0 kJ·mol-1,正反应是放热反应,当反应达到平衡后,温度升高,平衡向左(逆反应)移动,导致NO的物质的量逐渐减小,即C点比B点所产生的NO的物质的量少;
(4)①多元弱酸电离时分步进行,但第一步是主要的,
H2S![]() H+
H+
起始物质的量浓度(mol L-1) 0.1 0 0
起始物质的量浓度(mol L-1) x x x
起始物质的量浓度(mol L-1) 0.1-x x x
则K1(H2S) =1.3×10-7≈![]() ,解得x≈1.3×10-4mol L-1,0.l mol L-1氢硫酸的pH≈4;
,解得x≈1.3×10-4mol L-1,0.l mol L-1氢硫酸的pH≈4;
②若0.lmol L-1氢硫酸与0.0lmol L-1氢硫酸中的c(S2-)相等,则可近似认为HS-的浓度和H+相等,此时K2(H2S) =[c(H+)c(S2-)]÷c(HS-)=7.1×10-15,c(S2-)=7.1×10-15mol L-1;
③溶液中c(S2-)为7.1×10-15mol·L-1,根据Ksp(CuS) =c(Cu2+) ×c(S2-)=8.5×10-45,可知c(Cu2+) =8.5×10-45÷7.1×10-15=1.2×10-30mol·L-1。


科目:高中化学 来源: 题型:
【题目】常温下,向1L 0.1 mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如图所示(不考虑溶液体积的变化和氨的挥发),下列说法正确的是
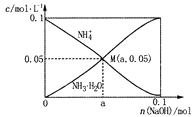
A. M点溶液中水的电离程度比原溶液大
B. a=0.05
C. 当n(NaOH)=0.05mol时溶液中有:
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D. 在M点时,n(OH-)-n(H+)=(a-0.05)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol·L-1NH4Al(SO4)2溶液的pH随温度变化的关系如曲线1所示,下列说法中正确的是
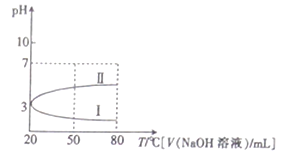
A. 0.1mol·L-1NH4Al(SO4)2溶液c(NH4+)大于等浓度的NH4HSO4溶液中c(NH4+)
B. 向100mL0.1mol·L-1NH4Al(SO4)2溶液中逐滴滴加80mL0.05 mol·L-1NaOH 溶液时,溶液pH的变化如曲线II
C. 升高温度,NH4Al(SO4)2溶液的pH减小,是因为促进了NH4Al(SO4)2的电离
D. 20℃时,0.1mol·L-1NH4Al(SO4)2溶液中:2c(SO42-)-c(NH4+)-3c(Al3+)=10-3mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中,进行可逆反应:A(s)+2B(g) ![]() C(g)+D(g),
C(g)+D(g),
当下列物理量不再发生变化时,能表明该反应已达到平衡状态的是
A. 容器内气体的压强 B. 混合气体的总物质的量
C. A的物质的量浓度 D. 混合气体的平均相对分子质量不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应:N2(g)+3H2(g) ![]() 2NH3(g)是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1mol H-H键、1mol N—H键、1mol N
2NH3(g)是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1mol H-H键、1mol N—H键、1mol N![]() N键放出的能量分别为436KJ、391KJ、946KJ。则:
N键放出的能量分别为436KJ、391KJ、946KJ。则:
(1)若1mol N2完全反应生成NH3可______(填“吸收”或“放出)热量_____KJ。
(2)如果将1mol N2 和 3mol H2混合,在一定条件下使其充分反应,反应放出的热量总小于上述数值,其原因是_____________________________________________________。
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器中进行,反应经过10min后,生成10mol NH3,则用N2表示的化学反应速率是________mol·L -1·min-1。
(4)一定条件下,当成合成氨反应达到化学平衡时,下列说法正确的是(____)
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d. N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在空气中久置会发生变质,且在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是( )
A.氢氧化钠固体
B.氯化钠固体
C.金属钠
D.生石灰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com