
分析 (1)裂解得到不饱和烃,乙烯是石油裂解后的产物;
(2)乙烯中的官能团为碳碳双键,能够和溴加成反应;
(3)根据烷烃的同系物来解答,结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物.
解答 解:(1)石油的裂解是采用较高的温度,让大分子烃类有机物成为小分子烃的过程,裂解得到不饱和烃,乙烯是石油裂解后的产物,
故答案为:裂解;
(2)乙烯中的官能团为碳碳双键,能够和溴加成,故将乙烯通入溴水中,观察到的现象是溴的红棕色褪去,碳碳双键变单键,断键处加上加成溴原子,方程式为Br2+CH2=CH2→BrCH2-CH2Br,
故答案为:CH2=CH2+Br2→CH2BrCH2Br; 加成反应;
(3)乙烯和氢气的加成产物乙烷,C3H8与乙烷是同系物.
故答案为:C.
点评 本题主要考查了乙烯的结构与性质,题目难度不大,根据所学知识即可完成,平时注意基础知识的积累.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
| A. | 热稳定性:正丁烷>异丁烷 | |
| B. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)→4CO2(g)+6H2O(g)△H=-1560.8kJ•mol-1 | |
| C. | 正戊烷的燃烧热大约在3540kJ•mol-1左右 | |
| D. | 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
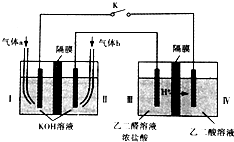 乙醛酸(HOOC-CHO)是有机合成的重要中间体.某同学组装了下图所示的电化学装置,电极材料Ⅰ~Ⅳ均为石墨,左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸.下列说法不正确的是( )
乙醛酸(HOOC-CHO)是有机合成的重要中间体.某同学组装了下图所示的电化学装置,电极材料Ⅰ~Ⅳ均为石墨,左池为氢氧燃料电池,右池为用“双极室成对电解法”生产乙醛酸,关闭K后,两极室均可产生乙醛酸,其中乙二醛与Ⅲ电极的产物反应生成乙醛酸.下列说法不正确的是( )| A. | 电极Ⅱ上的电极反应式:O2+4e-+2H2O═4OH- | |
| B. | 电极Ⅳ上的电极反应式:HOOC-COOH+2e-+2H+═HOOC-CHO+H2O | |
| C. | 乙二醛与Ⅲ电极的产物反应生成乙醛酸的化学方程式:Cl2+OHC-CHO+H2O=2HCl+HOOC-CHO | |
| D. | 若有2 mol H+ 通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | B. | N2的结构式:N≡N | ||
| C. | Na的原子结构示意图: | D. | CH4分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物可以分解为PH3和HI或H2和I2 | |
| C. | 这种化合物能跟碱反应 | |
| D. | 该化合物可以由PH3和HI化合而成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相等物质的量的物质燃烧所消耗O2的量:环已烷>苯>苯甲酸 | |
| B. | 密度:CCl4>H2O>乙酸乙酯 | |
| C. | 相等质量的物质燃烧所消耗O2的量:乙炔>乙烯>乙烷 | |
| D. | 熔点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中所有的族都是由长、短周期的元素共同组成 | |
| B. | 最外层电子数相同的元素不一定都是同一族 | |
| C. | 非金属元素都是主族元素,金属元素都是副族元素 | |
| D. | 元素周期表中共有18个纵行,每个纵行都是一个族,共有18个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | 50 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 粉末 | 15 | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com