
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他均为Cu,则( )

A.电流方向:电极Ⅳ→A→电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e-===Cu
科目:高中化学 来源: 题型:
在一定条件下,将E(g)和F(g)充入体积不变的2 L密闭容器中,发生下述反应,并于5 min末达到平衡:2E(g)+F(g)2G(g)。有关数据如下:
| E(g) | F(g) | G(g) | |
| 初始浓度/mol·L-1 | 2.0 | 1.0 | 0 |
| 平衡浓度/mol·L-1 | c1 | c2 | 0.4 |
下列判断正确的是( )
A.反应在前5 min内,v(E)=0.04 mol·L-1·min-1
B.其他条件不变,若增大E的浓度,则达平衡时E的转化率会增大
C.其他条件不变,降低温度,平衡时n(E)=3.0 mol,则反应的ΔH>0
D.平衡后移走2.0 mol E和1.0 mol F,在相同条件下再达平衡时,c(G)<0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
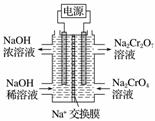
根据2CrO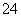 +2H+Cr2O
+2H+Cr2O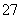 +H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应式为________________________________________________________________________。
+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,其电极反应式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
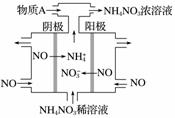
电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是________,说明理由:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是用铁铆钉固定两个铜质零件的示意图,若该零件置于潮湿空气中,下列说法正确的是( )
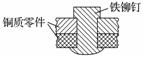
A.发生电化学腐蚀,铜为负极,铜极产生H2
B.铜易被腐蚀,铜极上发生还原反应,吸收O2
C.铁易被腐蚀,铁发生氧化反应,Fe-2e===Fe2+
D.发生化学腐蚀:Fe+Cu2+===Cu+Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发、利用的大致年限。
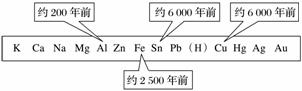
根据上图回答下列问题。
(1)铝是地壳中含量最高的金属元素,为什么人类对铝的使用比铁、铜晚得多?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com