
有一混合溶液中含有以下离子中的若干:K+、NH4+、Cl-、HCO3-、SO32-、SO42-、Ag+。现取等体积的两份溶液进行如下实验:
(1)第一份加入足量的NaOH溶液,无沉淀;加热,收集到标准状况下的气体336 mL。
(2)第二份加入足量的用盐酸酸化的BaCl2溶液,产生2.33g白色沉淀,同时收集到标准状况下的气体336 mL,该气体能使品红溶液褪色。
根据上述实验,下列推断正确的是( )
A. K+一定存在 B. Ag+和Cl-一定不存在
C. HCO3-一定不存在 D. 混合溶液中一定有0.015 mol SO32-
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
常温下能大量共存于同一溶液中,但当使溶液pH=0时会放出气体,当pH=14时又会产生白色沉淀的是 ( )
A.Fe3+、Ba2+、K+、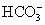 、SCN-、Cl-
、SCN-、Cl-
B.Mg2+、Na+、K+、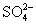 、Br-、
、Br-、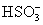
C.Ba2+、Al3+、K+、Cl-、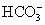 、
、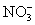
D.Fe3+、Na+、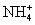 、
、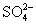 、
、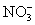 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构
B.P4和CH4都是正四面体形分子且键角都为109°28′
C.NH4+的电子式为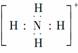 ,离子呈平面正方形结构
,离子呈平面正方形结构
D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的离子,aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A.原子半径 A>B>D>C B.原子序数 a>b>d>c
C.离子半径 C>D>B>A D.单质的还原性 A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D与F为同一周期,A与D、C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素。又知六种元素所形成的常见单质在常温压下有三种是气体,三种是固体。
请回答下列问题:
(1) 工业上用A和B的单质化合制备化合物X,该反应的化学方程式
(2)若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式: 。
(3)若D、E、F的最高价氧化物的水化物两两能发生反应,则E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式
(4)用电子式表示化合物D2F的形成过程 。
(5)由A、B、C三种元素组成的化合物X中共含有9个原子,X中所含化学键类型有
查看答案和解析>>
科目:高中化学 来源: 题型:
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g) N2(g)+O2(g) K1=1×1030
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2O(g) K2=2×1081
2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是( )
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量的浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
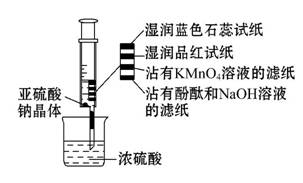
A.蓝色石蕊试纸先变红后褪色
B.沾有KMnO4溶液的滤纸褪色,证明了SO2的漂白性
C.品红试纸褪色,证明了SO2的漂白性
D.沾有酚酞和NaOH溶液的滤纸褪色,证明了SO2的漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com