
室温下,0.1mol·L-1CH3COONa溶液与 0.1 mol·L-1NaCl溶液等体积混合(忽略溶液体积变化),下列有关叙述正确的是
A.混合前CH3COONa溶液中由水电离出来的c(OH—)>1×10-7 mol·L-1
B.混合前NaCl溶液中:c(Na+) + c(OH—)= c(Cl-)+c(H+)
C.混合溶液中 :c(Cl-) >c(CH3COOH) >c(OH—)
D.混合溶液中:c(Cl-) + c(CH3COO-) =0.1mol·L-1
AB
【解析】
试题分析:A、醋酸钠溶液中醋酸根离子水解会促进水的电离,使水电离产生的c(OH—) >1×10-7 mol·L-1,正确;B、根据电荷守恒,应为c(Na+) + c(H+) = c(Cl-)+ c(OH—),混合前溶液呈中性有c(H+)=c(OH—),所以交换后等式仍成立,正确;C、醋酸根离子水解产生醋酸分子和氢氧根离子,而水解使非常微弱的,所以c(OH—) >c(CH3COOH),错误;D、根据物料守恒,混合溶液中c(Cl-) + c(CH3COO-)+ c(CH3COOH)=0.1mol/L,错误,答案选AB。
考点:考查混合溶液中水电离程度的判断,电荷守恒、物料守恒规律的应用,离子浓度的大小比较


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:选择题
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是
|
| X | Y |
Z | W |
|
|
A.Y元素最高价氧化物对应的水化物化学式为H2YO3
B.原子半径由小到大的顺序为:Y<X<W<Z
C.室温下,Z和W的单质均能溶于浓硝酸
D.X、Z两种元素的氧化物中所含化学键类型相同
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:选择题
下表中根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 某钠盐W中加入稀硫酸,产生的无色无味的气体通入澄清石灰水 | 石灰水变浑浊 | W可能是Na2CO3 |
B | 蘸有浓氨水的玻璃棒靠近溶液X | 有白烟产生 | X一定是浓盐酸 |
C | 强酸性溶液Y中加入Ba(NO3)2溶液,静置后再加入KSCN溶液 | 先有白色沉淀, 后溶液又变红 | Y中一定含有SO42-和Fe3+ |
D | 少量气态炔烃Z通入pH=a的溴水中 | 溴水褪色,溶液的pH仍约为a | Z与溴发生了取代反应 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:选择题
利用下列实验装置进行的相应实验,能达到实验目的的是
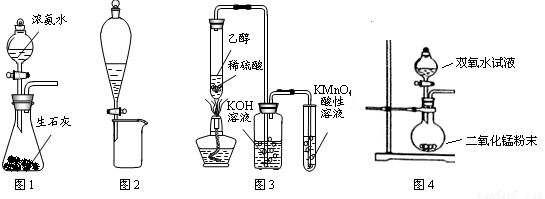
A.图1所示装置可制备氨气
B.图2所示装置可分离CH3CH2OH和CH3COOC2H5的混合液
C.图3所示装置可制备、收集乙烯并验证其易被氧化
D.图4所示装置可制备氧气
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:选择题
五颜六色的颜色变化增添了化学的魅力,对下列有关反应的颜色叙述正确的是
①新制氯水久置后→浅黄绿色消失;
②淀粉溶液遇碘单质→蓝色;
③氯化铁溶液滴入甲苯中→紫色;
④热的黑色氧化铜遇乙醇→红色
A.①③④ B.①②④ C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省茂名市高三第二次高考模拟理综化学试卷(解析版) 题型:选择题
下列叙述中不正确的是:
A.金属的电化学腐蚀比化学腐蚀普遍
B.钢铁在干燥空气里不易腐蚀
C.用铝质铆钉来接铁板,铁板易被腐蚀
D.金属腐蚀的本质是M-ne-=Mn+而被损耗
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省肇庆市高三级第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列实验操作、现象和解释都正确的是
选项 | 实验操作 | 现象 | 解释 |
A. | 向某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有CO32? |
B. | 新制Fe(OH)2露置于空气中一段时间 | 白色固体迅速变为灰绿色,最终变为红褐色 | 说明Fe(OH)2易被氧化成Fe(OH)3 |
C. | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 上层呈紫红色,下层有白色沉淀生产 | 铜离子可以氧化碘离子,白色沉淀可能为CuI |
D. | 向某无色溶液中滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省潮州市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.常温下,9g H2O中含NA个O–H键
B.1 molFe2+与足量稀硝酸反应,转移3 NA个电子
C.常温常压下,22. 4L SO2和O2的混合气体中含2NA个氧原子
D.0. 1 mol·L–1KAl(SO4)2溶液中含0.2NA个SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省广州市番禺区高考统考(一)理综化学试卷(解析版) 题型:填空题
对大气污染物SO2、NOx进行研究具有重要环保意义。请回答下列问题:
(1)为减少SO2的排放,常采取的措施是将煤转化为清洁气体燃料。
已知:① H2(g)+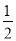 O2(g)=H2O(g) △H=-241.8kJ·mol-1
O2(g)=H2O(g) △H=-241.8kJ·mol-1
②C(s)+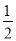 O2(g)=CO(g) △H=-110.5kJ·mol-1
O2(g)=CO(g) △H=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
(2)已知汽车汽缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H
2NO(g) △H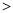 0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
0,若1.0 mol空气含0.80 mol N2和0.20 mol O2,1300oC时在2.0 L密闭汽缸内经过5s反应达到平衡,测得NO为1.6×10-3mol。
①在1300oC 时,该反应的平衡常数表达式K= 。5s内该反应的平均速率ν(N2) = (保留2位有效数字);
②汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
(3)汽车尾气中NO和CO的转化。当催化剂质量一定时,增大催化剂固体的表面积可提高化学反应速率。下图表示在其他条件不变时,反应2NO(g)+2CO(g)  2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g)+N2(g) 中,NO的浓度c(NO)随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
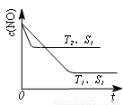
①该反应的△H 0 (填“>”或“<”)。
②若催化剂的表面积S1>S2,在右图中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com