
如图,在甲、乙两个容器中,分别加入0.1mol/LNaCl的溶液与0.1mol/L![]() 的溶液后,以Pt为电极进行电解时,在1、2、3、4各电极上生成物的物质的量之比为
的溶液后,以Pt为电极进行电解时,在1、2、3、4各电极上生成物的物质的量之比为

[ ]
A.2∶2∶4∶1 B.2∶4∶4∶1
C.2∶2∶1∶4 D.2∶4∶2∶1
科目:高中化学 来源: 题型:阅读理解
 (2012?烟台一模)煤的气化是高效、清洁的利用煤炭的重要途径之一.
(2012?烟台一模)煤的气化是高效、清洁的利用煤炭的重要途径之一.| 1 |
| 2 |
| 1 |
| 2 |
| H2O | CO | CO2 | H2 | |
| 甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
| 乙 n/mol | 0.20 | 0.20 | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
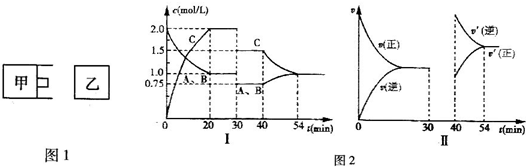
| 4 |
| 3 |
| 4 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
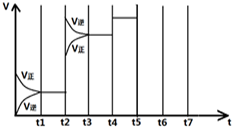 在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:
在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙两个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热(Q),及平衡时的转化率(X)如下表所示:| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2 | O2 | SO3 | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 1 | Q2= 39.4 |
X2 |
| t 1-t 2 | t 3-t 4 | t 4-t 5 | t 6-t 7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省孝感市高三第二次统考理综化学试卷(解析版) 题型:填空题
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g) +7O2(g) = 6CO(g)+8H2O(g)?? △H = -2389.8 kJ/mol
②2CO(g) + O2(g) = 2CO2(g)????????????? △H = -566 kJ/mol
③H2O(l) = H2O(g)???? △H = + 44.0 kJ/mol
(1)写出C3H8燃烧时燃烧热的热化学方程式???????????????????????????????????????????? 。
(2)C3H8在不足量的氧气里燃烧,生成CO、CO2、H2O(g),将所有的产物通入一个体积固定的密闭
容器中,在一定条件下发生如下可逆反应: CO(g) +? H2O(g) CO2(g) +? H2(g)
CO2(g) +? H2(g)
该反应的平衡常数与温度的关系如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
保持温度为800℃,在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,充分反应直至达到平衡。
| H2O | CO | CO2 | H2 |
甲 (质量/g) | 1.8 | 8.4 | a | 1 |
乙 (质量/g) | 1.8 | 2.8 | 0 | 0 |
①起始时,要使甲容器中反应向正反应方向进行,则a的取值范围是????????????????? ;达到平衡
时,乙容器中CO的转化率为???????? 。
②如图表示上述甲容器中反应在t1时刻达到平衡,在t2时刻因改变某一个条件而发生变化的情况。则t2时刻改变的条件可能是???????????????????????????? 、??????????????????? (答两个要点即可)。

(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3。
① Na2CO3溶液中离子浓度由大到小的顺序为 ?????????? ??? ;
② 已知25℃时,H2CO3的电离平衡常数K1 = 4.4×10-7 mol/L、K2 = 4.7×10-11 mol/L,当Na2CO3溶液的pH为11时, 溶液中c(HCO3-)∶c(CO32-) = ?????????? 。
③ 0.1 mol/L Na2CO3溶液中c(OH-) - c(H+ ) = ?????????????????????? [用含c(HCO3-)、c(H2CO3)的符号表示]。
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温恒容时,NO2和N2O4之间发生反应N2O4(g) ![]() 2NO2(g),如图所示。
2NO2(g),如图所示。

(1)曲线________(填“X”或“Y”)表示NO2的物质的量随时间变化的曲线。
(2)若升高温度,则v(正)________,v(逆)________(填“加快”或“减慢”)。
(3)若上述反应在甲、乙两个相同容器内同时进行,分别测得甲中v(NO2)=0.3 mol·(L·min)-1,乙中v(N2O4)=0.2 mol·(L·min)-1,则________容器中反应更快。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com