
| 起始(mL) | 终点(mL) | |
| 1 | 5.00 | 20.02 |
| 2 | 3.00 | 18.00 |
| 3 | 4.00 | 18.98 |
分析 (2)淀粉遇碘变蓝,可检验碘;
(3)维生素C是一种水溶性维生素,其水溶液呈酸性,且向锥形瓶中移入20.00mL待测橙汁,以此选择仪器;
(5)滴定时,左手控制活塞,眼睛观察锥形瓶中颜色的变化,以此判断滴定终点;
(6)由数据可知,取三次实验的平均值,则在实验中消耗的标准碘溶液的体积是$\frac{(20.02-5)+(18.00-3.00)+(18.98-4.00)}{3}$≈15mL,15mL标准碘溶液碘的质量为 15mL×10-3(L/mL)×8.00×10-3mol•L-1×254(g/mol)×1000(mg/g)=30.48 mg,设20.0mL待测橙汁中维生素C的质量为x,结合C6H8O6+I2→C6H6O6+2H++2I-计算;
(7)此橙汁中维生素C的含量是1056.00mg/L,新鲜橙汁中维生素C的含量在500mg/L左右,可能将维生素C作为添加剂.
解答 解:(2)由于碘能使淀粉变蓝色,所以指示剂应选用淀粉试液,故答案为:淀粉溶液;
(4)量取20.00mL待测橙汁,应用酸式滴定管量取,故答案为:酸式滴定管;
(5)由滴定操作可知,用左手控制滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,直到滴定终点当最后一滴标准液滴入时,溶液由无色变为蓝色,且半分钟内不褪色,维生素C已全部参加了反应,
故答案为:活塞;锥形瓶中溶液颜色变化;最后一滴标准液滴入时,溶液由无色变为蓝色,且半分钟内不褪色;
(6)由数据可知,取三次实验的平均值,则在实验中消耗的标准碘溶液的体积应该是15mL,
15mL标准碘溶液碘的质量为 15mL×10-3(L/mL)×8.00×10-3mol•L-1×254(g/mol)×1000(mg/g)=30.48 mg,
设20.0mL待测橙汁中维生素C的质量为x
C6H8O6+I2→C6H6O6+2H++2I-
176 254
x 30.48mg
176×30.48mg=254×x
解得:x=21.12mg,
则1L中含维生素C的质量为21.12mg×$\frac{1000mL}{20mL}$=1056.00mg,
则此橙汁中维生素C的含量是1056.00mg/L,
故答案为:1056.00;
(7)由于此橙汁中维生素C的含量是1056.00mg/L,从数据分析来看,该牌子的橙汁不是天然橙汁;由于在新鲜橙汁中,维生素C含量约为500mg/L,此橙汁中维生素C的含量大于500 mg/L,制造商可能将橙汁浓缩或将维生素C作为添加剂进行添加,从实际上看最有可能为B,
故答案为:不是;B.
点评 本题考查物质的含量测定实验,为高频考点,把握滴定原理的应用、物质含量的计算、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验原理、实验数据的综合应用,题目难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:实验题
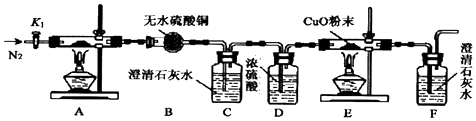
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
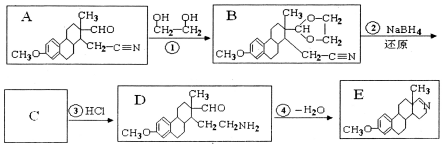
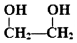 的名称为乙二醇;写出其与对苯二甲酸反应生成高聚物的化学方程式
的名称为乙二醇;写出其与对苯二甲酸反应生成高聚物的化学方程式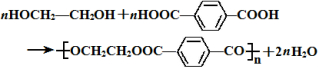 ;
;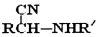 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$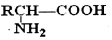
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应原理在科研和工农业生产中有广泛应用.
化学反应原理在科研和工农业生产中有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | T1时0~10 min NO2的平均反应速率为0.15 mol•L-1•min-1 | |
| B. | T2时CH4的平衡转化率为70.0% | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径 (10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
 ,G与F分别形成的简单离子半径大小关系为N3->Na+.
,G与F分别形成的简单离子半径大小关系为N3->Na+. 、
、 .
. ;
; ,该化合物与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑..
,该化合物与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑..查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com