
【题目】在常温下,pH=9的NaOH溶液和CH3COONa两种溶液中,假设由水电离产生的OH- 离子浓度分别为a和b,则a与b的关系为( )
A. a>b B. a=10﹣4b C. b=10﹣4a D. a=b
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值,下列说法正确的是
A. 20gD2O中含有的中子数为8NA
B. 3.36LNO2 与足量的水充分反应后,生成0.05NA 个NO 分子
C. 1mol 碳酸钠和碳酸氢钠的混合物中碳酸根离子的数目为NA
D. 3mol 单质Fe 完全燃烧转变为Fe3O4,失去8NA 个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中 ( )。
A.水的电离程度始终增大
B.![]() 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH![]() )=c(CH3COO-)
)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于砹(85At)及其化合物的说法中,正确的是 ( )
A. 稳定性:HAt>HCl B. 氧化性:At2>I2
C. At2为分子晶体 D. NaAt的水溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡的是___________。
A.![]()
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:__________________________。
③氨基甲酸铵分解反应的焓变△H_________0,熵变△S________0(填>、<或=)。
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
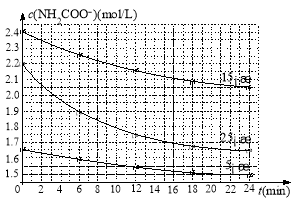
计算25℃时,0~6min氨基甲酸铵水解反应的平均速率_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2 转变为H2、CO。其过程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是
A. 该过程中CeO2为H2O、CO2 转变为H2、CO的催化剂
B. 该过程实现了太阳能向化学能的转化
C. 1mol CeO2参加反应,共生成2xmol的气体
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝分别和O2、O3反应生成Al2O3,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。下列有关说法中不正确的是
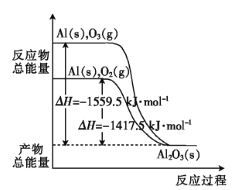
A. Al(s)与O3(g)反应的热化学方程式为2Al(s)+O3(g)=Al2O3(s) ΔH=-1559.5kJ·mol-1
B. 等质量的O2比O3的能量低,O2比O3稳定
C. 1 mol O2完全转化为O3,需吸收142 kJ的热量
D. Al(s)与O2(g)反应的热化学方程式为4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2835kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com