
”¾ĢāÄæ”æµ°°×ÖŹŹĒ¹¹³ÉÉśĪļĢåÄŚµÄ»ł±¾ĪļÖŹ£¬µ°°×ÖŹµÄ×é³ÉŌŖĖŲÖ÷ŅŖÓŠĒā”¢Ģ¼”¢µŖ”¢Ńõ”¢Įņ£¬Ķ¬Ź±»¹ÓŠĪ¢ĮæŌŖĖŲĢś”¢ŠæµČ”£»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)Ģ¼”¢µŖ”¢ŃõČżŌŖĖŲµÄµŚŅ»µēĄėÄÜÓÉŠ”µ½“óµÄĖ³ŠņĪŖ________________(ÓĆŌŖĖŲ·ūŗűķŹ¾)£»
(2)N3£µÄĮ¢Ģå¹¹ŠĶŹĒ___________ŠĪ£ŗÓėN3£»„ĪŖµČµē×ÓĢåµÄŅ»ÖÖ·Ö×ÓŹĒ___________(Ģī·Ö×ÓŹ½)”£
(3)½«×ćĮæµÄ°±Ė®ÖšµĪµŲ¼ÓČėµ½ZnSO4ČÜŅŗÖŠ£¬ĻČÉś³É³Įµķ£¬Č»ŗó³ĮµķČܽāÉś³ÉÅäŗĻĪļ[Cu(NH3)4SO4£¬ÅäĪ»»ÆŗĻĪļÖŠµÄŃōĄė×Ó½į¹¹Ź½ĪŖ___________£»SO42£ÖŠµÄĮņŌ×ÓŌӻƷ½Ź½ĪŖ___________£»ÓĆ¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪ½āŹĶSO42£µÄ¼ü½Ē“óÓŚSO32£µÄŌŅņŹĒ_________________________________”£
(4)ķŚ»ÆŠæ¾§ĢåÓŠĮ½ÖÖ½į¹¹£¬ĘäÖŠŅ»ÖÖ¾§°ū½į¹¹ČēĻĀĶ¼£¬¾§°ūÖŠÓėZnŌ×Ó¾ąĄė×ī½üµÄTeŌ×ÓĪ§³É____ĢåĶ¼ŠĪ£»ÓėTeŌ×Ó¾ąĄė×ī½üµÄTeŌ×ÓÓŠ___øö£»ČōZnÓė¾ąĄė×ī½üµÄTeŌ×Ó¼ä¾ąĪŖapm£¬Ōņ¾§ĢåĆܶČĪŖ____g/cm3”£
(ŅŃÖŖĻą¶ŌŌ×ÓÖŹĮæ£ŗZn-65”¢Te-128)
”¾“š°ø”æC<O<N Ö±Ļß N2O»ņCO2»ņBeCl2 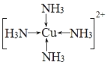 sp3 Į½ÖÖĄė×ÓµÄÖŠŠÄĮņŌ×Ó¾łĪŖsp3Ōӻƣ¬ SO42-֊ƻӊ¹Ā¶Ōµē×Ó£¬SO32-ÓŠŅ»¶Ō¹Ā¶Ōµē×Ó£¬¹Āµē×Ó¶Ō¶Ō³É¼üµē×ÓÓŠ¼·Ń¹×÷ÓĆ£¬Ņņ“Ė¼ü½ĒøüŠ” ÕżĖÄĆęĢå 12
sp3 Į½ÖÖĄė×ÓµÄÖŠŠÄĮņŌ×Ó¾łĪŖsp3Ōӻƣ¬ SO42-֊ƻӊ¹Ā¶Ōµē×Ó£¬SO32-ÓŠŅ»¶Ō¹Ā¶Ōµē×Ó£¬¹Āµē×Ó¶Ō¶Ō³É¼üµē×ÓÓŠ¼·Ń¹×÷ÓĆ£¬Ņņ“Ė¼ü½ĒøüŠ” ÕżĖÄĆęĢå 12 ![]()
”¾½āĪö”æ
(1)øł¾ŻŌŖĖŲµÄµŚŅ»µēĄėÄܱä»Æ¹ęĀÉ·ÖĪö£»
(2)Ō×ÓøöŹżĻąµČĒŅ¼Ūµē×ÓŹżĻąµČµÄĪ¢Į£ĪŖµČµē×ÓĢ壬N3-ÓėCO2»„ĪŖµČµē×ÓĢ壬¶žÕß½į¹¹ĻąĖĘ£»
(3)ŌŚĀēŗĻĪļÖŠŠÄĄė×ÓCuÓė°±·Ö×ÓÖ®¼äŠĪ³ÉÅäĪ»¼ü£¬Ķā½ēĄė×ÓSO42-ÖŠSŌ×Ó²ÉÓĆsp3Ōӻƣ¬“ÓÖŠŠÄŌ×ÓŹĒ·ńŗ¬ÓŠ¹Āµē×Ó¶Ō·ÖĪöSO42£”¢SO32-£»
(4)øł¾ŻķŚ»ÆŠæ¾§Ģå½į¹¹”¢²ÉÓĆ¾łĢÆ·½·Ø¼ĘĖćĪ¢Į£ŹżÄ棬²¢¼ĘĖć¾§ĢåĆܶȔ£
(1)Ņ»°ćĒéæöĻĀĶ¬Ņ»ÖÜĘŚµÄŌŖĖŲ£¬ŌŖĖŲµÄŌ×ÓŠņŹżŌ½“ó£¬ŌŖĖŲµÄµŚŅ»µēĄėÄÜŌ½“󣬵«ÓÉÓŚNŌ×Ó×īĶā²ćµē×Ó“¦ÓŚ2p¹ģµĄµÄ°ė³äĀśĪȶØדĢ¬£¬ĖłŅŌŹ§Č„µē×Ó±ČOÄŃ£¬¼“µŚŅ»µēĄėÄÜN>O£¬Ņņ“ĖĢ¼”¢µŖ”¢ŃõČżŌŖĖŲµÄµŚŅ»µēĄėÄÜÓÉŠ”µ½“óµÄĖ³ŠņĪŖC<O<N£»
(2)Ō×ÓøöŹżĻąµČĒŅ¼Ūµē×ÓŹżĻąµČµÄĪ¢Į£ĪŖµČµē×ÓĢ壬ŌņÓėN3-»„ĪŖµČµē×ÓĢåµÄ·Ö×ÓÓŠ£ŗN2O»ņCO2»ņCS2µČ£¬N3-ÓėCO2»„ĪŖµČµē×ÓĢ壬¶žÕß½į¹¹ĻąĖĘ£¬ĖłŅŌN3£µÄĮ¢Ģå¹¹ŠĶŹĒĪŖÖ±ĻߊĶ½į¹¹£»
(3)ŌŚÅäŗĻĪļ[Cu(NH3)4]SO4ÖŠµÄČ½ēĄė×ÓµÄÖŠŠÄCu2+Ąė×Ó£¬ÓėNH3µÄNŌ×ÓŠĪ³ÉÅäĪ»¼ü£¬½įŗĻ4øö°±·Ö×Ó£¬ÅäĪ»»ÆŗĻĪļÖŠµÄŃōĄė×Ó[Cu(NH3)4]2+ĪŖÕżĖÄĆęĢåŠĪ£» SO42-ĪŖĶā½ēĄė×Ó£¬ĘäÖŠSŌ×Ó²ÉÓĆsp3Ōӻƣ¬ĪŽĀŪŹĒSO42£»¹ŹĒSO32-£¬SŌ×Ó¶¼ŹĒ²ÉÓĆsp3Ōӻƣ¬ÓÉÓŚSO42-֊ƻӊ¹Ā¶Ōµē×Ó£¬SO32-µÄÖŠŠÄSŌ×ÓÉĻÓŠ¹Ā¶Ōµē×Ó£¬¹Ā¶Ōµē×Ó¶Ō³É¼üµē×Ó¶ŌÓŠÅųā×÷ÓĆ£¬Ź¹Ęä¼ü½Ē±äŠ”£»
(4)øł¾ŻķŚ»ÆŠæ¾§Ģå½į¹¹ÖŠTeÓėZnĻą¶ŌĪ»ÖĆæÉÖŖ£ŗ¾§°ūÖŠÓėZnŌ×Ó¾ąĄė×ī½üµÄTeŌ×ÓÓŠĖÄøö£¬ĖüĆĒĪ§³ÉÕżĖÄĆęĢåŠĪ£»TeŌ×ÓĪ»ÓŚ¾§°ūµÄ¶„µćŗĶĆęŠÄÉĻ£¬ŌŚŅ»øö¾§°ūÖŠÓėTeŌ×ÓĪ»ÖĆ×ī½üĒŅĻąµČµÄTeŌ×ÓŌŚČżøöĘ½ĆęµÄÖŠŠÄ£¬ĶعżŅ»øö¶„µćÄܹ»ŠĪ³É8øö¾§°ū£¬ÓÉÓŚĆæøöTeŌ×ÓÖŲø“ŹżĮĖ2“Ī£¬ĖłŅŌÓėTeŌ×Ó¾ąĄė×ī½üµÄTeŌ×ÓÓŠŗ¬ÓŠTeŌ×ÓøöŹż£ŗ(3”Į8)”Ā2=12øö£»ČōÓėZn¾ąĄė×ī½üµÄTeŌ×Ó¼ä¾ąĪŖapm£¬ÓÉÓŚZnŌ×ÓĪ»ÓŚÕż·½ĢåµÄ¶Ō½ĒĻßµÄ![]() “¦£»Ōņ¾§°ū¶Ō½ĒĻßĪŖ4apm£¬¾§°ūµÄ±ß³¤LĪŖ
“¦£»Ōņ¾§°ū¶Ō½ĒĻßĪŖ4apm£¬¾§°ūµÄ±ß³¤LĪŖ![]() pm£¬ŌŚŅ»øö¾§°ūÖŠŗ¬ÓŠTe£ŗ
pm£¬ŌŚŅ»øö¾§°ūÖŠŗ¬ÓŠTe£ŗ![]() ”Į6=4£¬ŗ¬ÓŠZnŌ×ÓĪŖ4øö£¬¼“Ņ»øö¾§°ūÖŠŗ¬ÓŠ4øöZnTe£¬¹Ź¾§ĢåĆܶČĪŖ
”Į6=4£¬ŗ¬ÓŠZnŌ×ÓĪŖ4øö£¬¼“Ņ»øö¾§°ūÖŠŗ¬ÓŠ4øöZnTe£¬¹Ź¾§ĢåĆܶČĪŖ![]() g/cm3”£
g/cm3ӣ



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¶ĢÖÜĘŚŌŖĖŲX”¢Y”¢Z”¢WŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĻą¶ŌĪ»ÖĆČēĶ¼ĖłŹ¾£¬ĘäÖŠWŌ×ÓµÄ×īĶā²ćµē×ÓŹżŹĒ×īÄŚ²ćµē×ÓŹżµÄ3±¶”£ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ
![]()
A. Ō×Ó°ė¾¶£ŗr(W)£¾r(Z)£¾r(Y)£¾r(X)
B. YŌŖĖŲµÄµ„ÖŹÖ»ÄÜøśĖį·“Ó¦£¬²»ÄÜøś¼ī·“Ó¦
C. ×ī¼ņµ„ĘųĢ¬Ēā»ÆĪļµÄČČĪČ¶ØŠŌ£ŗW£¾Z
D. WŌŖĖŲµÄø÷ÖÖŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļ¾łĪŖĒæĖį
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚÉś²śÉś»īÖŠµŖ¼°Ęä»ÆŗĻĪļµÄÓ¦ÓĆŗĶ“¦ĄķŅŃŅżĘš¹ć·ŗ¹Ų×¢”£
£Ø1£©ŗĻ³É°±µÄ·“Ó¦ŌĄķĪŖN2(g)+3H2(g)![]() 2NH3(g) ¦¤H = -92.4 kJ/mol£¬ČēĻĀĶ¼ĖłŹ¾£¬½«6 mol N2ŗĶ14 mol H2³äČėŅ»ČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£¬·“Ó¦æŖŹ¼Ź±»īČūµÄĪ»ÖĆČēĶ¼1ĖłŹ¾£¬µ±·“Ó¦“ļµ½Ę½ŗāŹ±£¬»īČūĪ»ÖĆČēĶ¼2ĖłŹ¾£¬ĻĀĮŠ±ķŹöÄÜÓĆĄ“ÅŠ¶ĻĶ¼2ĖłŹ¾×“Ģ¬ŅŃ“ļĘ½ŗāµÄŹĒ________£¬ŌņøĆĢõ¼žĻĀ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ________”£
2NH3(g) ¦¤H = -92.4 kJ/mol£¬ČēĻĀĶ¼ĖłŹ¾£¬½«6 mol N2ŗĶ14 mol H2³äČėŅ»ČŻ»żæɱäµÄĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£¬·“Ó¦æŖŹ¼Ź±»īČūµÄĪ»ÖĆČēĶ¼1ĖłŹ¾£¬µ±·“Ó¦“ļµ½Ę½ŗāŹ±£¬»īČūĪ»ÖĆČēĶ¼2ĖłŹ¾£¬ĻĀĮŠ±ķŹöÄÜÓĆĄ“ÅŠ¶ĻĶ¼2ĖłŹ¾×“Ģ¬ŅŃ“ļĘ½ŗāµÄŹĒ________£¬ŌņøĆĢõ¼žĻĀ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ________”£

A£®»īČū²»ŌŁŅĘ¶Æ B£®ČŻĘ÷ÄŚĘųĢåŃ¹Ēæ²»ŌŁøıä
C£®ČŻĘ÷ÄŚĘųĢåĆÜ¶Č²»ŌŁøıä D£®ČŻĘ÷ÄŚĘųĢåµÄĘ½¾ł·Ö×ÓÖŹĮæ²»ŌŁøıä
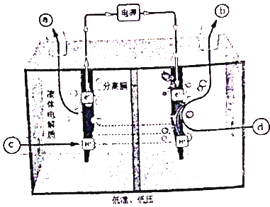
£Ø2£©ŃŠ¾æÕßĶعżĢ½Ė÷£¬·¢ĻÖĄūÓĆ·“ĻņČ¼ĮĻµē³ŲæÉŅŌŌŚĪĀŗĶµÄĢõ¼žĻĀ½«µē½āĖ®ÖĘĒāÓėµŖ”¢Ēā·“Ó¦ÖĘ°±ŗĻ²¢£Ø¼“½«µē½ā²śÉśµÄ»īŠŌĒā×÷ĪŖÖŠ¼ä²śĪļÖ±½Ó»¹ŌµŖĘų£©£¬Ę乤×÷ŌĄķŹ¾ŅāĶ¼ČēĻĀ£ŗŠ“³öŅõ¼«µē¼«·½³ĢŹ½________”£
£Ø3£©SCR·ØŹĒ¹¤ŅµÉĻĻū³żµŖŃõ»ÆĪļµÄ³£ÓĆ·½·Ø£¬·“Ó¦ŌĄķĪŖ£ŗ4NH3(g)+4NO(g)+ O2(g)![]() 4N2(g)+6H2O(g)£¬
4N2(g)+6H2O(g)£¬
¢ŁŅŃÖŖ4NH3(g)+ 3O2(g)![]() 2N2(g)+6H2O(g) ¦¤H1 = -1269.0 kJ/mol£»
2N2(g)+6H2O(g) ¦¤H1 = -1269.0 kJ/mol£»
N2(g)+ O2(g)![]() 2NO(g) ¦¤H2 = +180.8 kJ/mol
2NO(g) ¦¤H2 = +180.8 kJ/mol
Ōņ·“Ó¦4NH3(g)+4NO(g)+ O2(g)![]() 4N2(g)+6H2O(g)µÄ¦¤H = ________”£
4N2(g)+6H2O(g)µÄ¦¤H = ________”£
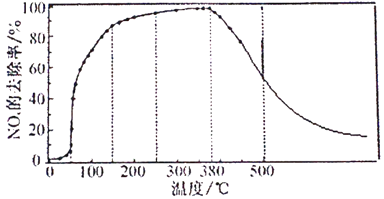
¢Ś½«Ņ»¶Ø±ČĄżµÄO2”¢NH3ŗĶNOxµÄ»ģŗĻĘųĢ壬ŌČĖŁĶØČė×°ÓŠ“߻ƼĮMµÄ·“ӦȯĘ÷ÖŠ·“Ó¦10Ź±²āµĆNOxµÄČ„³żĀŹĖę·“Ó¦ĪĀ¶ČµÄ±ä»ÆĒśĻßČēĻĀĶ¼ĖłŹ¾£¬Ēė½āŹĶµ±·“Ó¦ĪĀ¶ČøßÓŚ380”ꏱNOxµÄČ„³żĀŹĖęĪĀ¶ČÉżøßĻČŃøĖŁĻĀ½µŗó»ŗĀżĻĀ½µµÄŌŅņ________”£
¢ŪĒėŌŚĻĀĶ¼ÖŠ»³ö·“Ó¦8minŹ±NOxµÄČ„³żĀŹĖęĪĀ¶Č±ä»ÆµÄĒśĻß”£___
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖČÜŅŗÖŠÖ÷ŅŖ“ęŌŚĻĀĮŠĄė×Ó£¬ŹŌÅŠ¶ĻøĆČÜŅŗµÄČÜÖŹ²¢Š“³öĘäµēĄė·½³ĢŹ½£ŗ
(1)H£«”¢CH3COO-_____________”¢_____________________”£
(2)Fe3£«”¢SO42-_____________”¢_______________________”£
(3)Na£«”¢HCO3-_____________”¢_______________________”£
(4)H+ӢHS-ӢS2-_____________Ӣ______________________ӣ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æCu2OŹĒŅ»ÖÖ°ėµ¼Ģå²ÄĮĻ£¬»łÓŚĀĢÉ«»ÆѧĄķÄīÉč¼ĘµÄÖĘČ”Cu2OµÄµē½ā³ŲŹ¾ŅāĶ¼ČēÓŅ£¬µē½ā×Ü·“Ó¦ĪŖ£ŗ2Cu£«H2O![]() Cu2O£«H2”ü”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
Cu2O£«H2”ü”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A. ŹÆÄ«µē¼«ÉĻ²śÉśĒāĘų
B. Ķµē¼«·¢Éś»¹Ō·“Ó¦
C. Ķµē¼«½ÓÖ±Į÷µēŌ“µÄøŗ¼«
D. µ±ÓŠ0.1 molµē×Ó×ŖŅĘŹ±£¬ÓŠ0.1 mol Cu2OÉś³É
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬ĻÖÓŠÅØ¶Č¶¼ĪŖ0.1mol”¤L£1HA”¢HBµÄČÜŅŗø÷20mL£¬·Ö±šÓĆ0.1mol”¤L£1NaOHČÜŅŗµĪ¶Ø”£ČÜŅŗµÄpHÓė¼ÓČėNaOHČÜŅŗĢå»żVµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ĻĀĮŠÅŠ¶Ļ“ķĪóµÄŹĒ
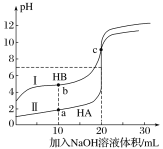
A. µĪ¶Ø¹ż³ĢÖŠ£¬Ė®µēĄėµÄc(H+)”¤c(OH£)¾ł²»±ä
B. ĻąĶ¬Ģõ¼žĻĀ£¬HBµÄµēĄė³Ģ¶ČŠ”ÓŚHAµÄµēĄė³Ģ¶Č
C. V=10mLŹ±£¬c(HB)+c(B£)=2c(Na+)
D. V=20mLŹ±£¬c(A£)>c(B£)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆ¾¼°ĘäŗĻ½šŹĒŅ»ÖÖÓĆĶ¾ŗܹćµÄ½šŹō²ÄĮĻ£¬ÄæĒ°ŹĄ½ēÉĻ60%µÄĆ¾ŹĒ“Óŗ£Ė®ÖŠĢįČ”µÄ”£Ö÷ŅŖ²½ÖčČēĻĀ£ŗ

(1)ĪŖĮĖŹ¹MgSO4×Ŗ»ÆĪŖMg(OH)2£¬ŹŌ¼Į¢ŁæÉŅŌŃ”ÓĆ________£¬ŅŖŹ¹MgSO4ĶźČ«×Ŗ»ÆĪŖ³Įµķ£¬¼ÓČėŹŌ¼ĮµÄĮæÓ¦ĪŖ________________”£
(2)¼ÓČėŹŌ¼Į¢Łŗó£¬Äܹ»·ÖĄėµĆµ½Mg(OH)2³ĮµķµÄ·½·ØŹĒ_____________”£
(3)ŹŌ¼Į¢ŚŃ”ÓĆ________£»Š“³öĘä·“Ó¦µÄĄė×Ó·½³ĢŹ½_______”£
(4)ĪŽĖ®MgCl2ŌŚČŪȌדĢ¬ĻĀ£¬Ķصēŗó²śÉśĆ¾ŗĶĀČĘų£¬øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĒļ¶¬¼¾ŹĒĪķö²øß·¢¼¾½Ś£¬ĘäÖŠĘū³µĪ²ĘųŗĶČ¼ĆŗĪ²ĘųŹĒŌģ³ÉĪķö²µÄÖ÷ŅŖŌŅņÖ®Ņ»”£
(1)¹¤ŅµÉĻĄūÓĆ¼×Ķé“߻ƻ¹ŌNOXæɼõÉŁµŖŃõ»ÆĪļµÄÅÅ·Å”£ŅŃÖŖ£ŗ
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g)”÷H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g)”÷H=-574kJ/mol
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g)”÷H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g)”÷H=-1160kJ/mol
¼×ĶéÖ±½Ó½«NO2»¹ŌĪŖN2µÄČČ»Æѧ·½³ĢŹ½ĪŖ_______________________________”£
(2)Ęū³µĪ²Ęų“߻ƾ»»ÆŹĒæŲÖĘĘū³µĪ²ĘųÅÅ·Å”¢¼õÉŁĘū³µĪ²ĘųĪŪČ¾µÄ×īÓŠŠ§µÄŹÖ¶Ī£¬Ö÷ŅŖŌĄķĪŖ2NO(g)+2CO(g)![]() N2(g)+2CO2(g)”÷H<O”£ĻņŅ»¶ØĢõ¼žĻĀµÄŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėNOŗĶCO£¬ÓĆ“«øŠĘ÷²āµĆøĆ·“Ó¦ŌŚ²»Ķ¬Ź±æĢNOŗĶCOµÄÅضČČēĻĀ±ķĖłŹ¾£ŗ
N2(g)+2CO2(g)”÷H<O”£ĻņŅ»¶ØĢõ¼žĻĀµÄŗćČŻĆܱÕČŻĘ÷ÖŠ³äČėNOŗĶCO£¬ÓĆ“«øŠĘ÷²āµĆøĆ·“Ó¦ŌŚ²»Ķ¬Ź±æĢNOŗĶCOµÄÅضČČēĻĀ±ķĖłŹ¾£ŗ
Ź±¼ä/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/mol”¤L-1 | 9.00”Į10-3 | 4.00”Į10-3 | 2.00”Į10-3 | 1.00”Į10-3 | 1.00”Į10-3 |
c(CO)/mol”¤L-1 | 9.00”Į10-3 | 4.00”Į10-3 | 2.00”Į10-3 | 1.00”Į10-3 | 1.00”Į10-3 |
¢ŁĻĀĮŠæÉÅŠ¶Ļ·“Ó¦“ļµ½Ę½ŗāדĢ¬µÄŹĒ___________(Ģī×ÖÄø“śŗÅ)”£
A.c(NO)²»ŌŁøıä B.c(NO)/c(CO)²»ŌŁøıä
C.c(NO)/c(CO2)²»ŌŁøıä D.V(CO)=V(CO2)
¢Ś“ĖĢõ¼žĻĀ“ļµ½Ę½ŗāŹ±£¬¼ĘĖćøĆ·“Ó¦µÄĘ½ŗā³£ŹżK=________”£
¢ŪĪŖĮĖĢįøßĪ²Ęų“¦ĄķµÄŠ§¹ū,æɲÉČ”µÄ“ėŹ©ÓŠ_____________________(Š“³öĮ½ÖÖ¼“æÉ)”£
(3)¹¤ŅµÉĻ³£²ÉÓĆ”°¼īČÜŅŗĪüŹÕ”±µÄ·½·ØĄ“Ķ¬Ź±ĪüŹÕSO2ŗĶµŖµÄŃõ»ÆĪļĘųĢå(NOx),ĒėŠ“³öĒāŃõ»ÆÄĘČÜŅŗĪüŹÕNOŗĶNO2£ØĮ½ÕßĢå»ż±Č1£ŗ1£©µÄĄė×Ó·½³ĢŹ½ ___________________”£
(4)īęŌŖĖŲ(Ce)ŹĒļēĻµ½šŹōÖŠ×ŌČ»·į¶Č×īøßµÄŅ»ÖÖ,³£¼ūÓŠ+3”¢+4Į½ÖÖ¼ŪĢ¬”£Īķö²ÖŠŗ¬ÓŠ“óĮæµÄĪŪČ¾ĪļNO£¬æÉŅŌ±»ŗ¬Ce4+µÄČÜŅŗĪüŹÕ,Éś³ÉNO2£”¢NO3££ØĮ½ÕßĪļÖŹµÄĮæÖ®±ČĪŖ1:1)”£æɲÉÓƵē½ā·Ø½«ÉĻŹöĪüŹÕŅŗÖŠµÄNO2-×Ŗ»ÆĪŖĪŽ¶¾ĪļÖŹ,Ķ¬Ź±ŌŁÉśCe4+,ĘäŌĄķČēĻĀĶ¼ĖłŹ¾”£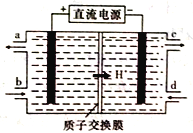
¢ŁCe4+“Óµē½ā²ŪµÄ_____(Ģī×ÖÄø“śŗÅ)æŚĮ÷³ö”£
¢ŚŠ“³öŅõ¼«µÄµē¼«·“Ó¦Ź½£ŗ______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æäå¼°Ęä»ÆŗĻĪļ¹ć·ŗÓĆÓŚŅ½Ņ©”¢ĖÜĮĻ×čČ¼¼ĮµČ£¬æąĀ±ĢįäåµÄ¹¤ŅµĮ÷³ĢČēĻĀ£ŗ
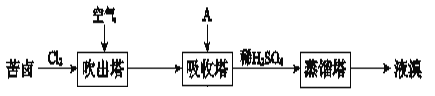
(1)Cl2ŗĶæąĀ±ÖŠµÄBr©·“Ӧɜ³ÉBr2µÄĄė×Ó·½³ĢŹ½ŹĒ_____”£
(2)½įŗĻŌŖĖŲÖÜĘŚĀɽāŹĶClµÄ·Ē½šŹōŠŌĒæÓŚBrµÄŌŅņ£ŗ_____”£
(3)ĪüŹÕĖžÖŠ£¬AĪüŹÕĮĖBr2ŗóµÄČÜŅŗÖŠŗ¬ÓŠBr©ŗĶBrO3©£¬ŌņAŹĒ_____£ØĢīŠņŗÅ£©”£
a£®NaClČÜŅŗ b£®Na2CO3ČÜŅŗ c£®SO2ĘųĢå
(4)“ÓĪüŹÕĖž³öĄ“µÄČÜŅŗÖŠ¼ÓČėĻ”H2SO4µĆµ½Br2µÄĄė×Ó·½³ĢŹ½ŹĒ_____”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com