
(12分) 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如下图所示。则:
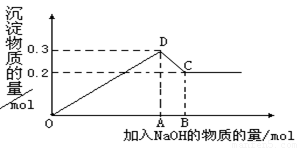
(1)写出代表各线段发生反应的离子方程式:
OD段 _________________________________,
DC段 _________________________________ 。
(2)原溶液中Mg2+、Al3+物质的量浓度之比为 。
(3)图中C点表示当加入 mol NaOH时,Al3+已经转化为 Mg2+已经转化为 。
(4)图中线段OA∶AB= 。
(1)Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓ ;
Al(OH)3+OH-=AlO2-+2H2O 每个2分共6分
(2)2∶1(1分)
(3)0.8 (1分) 全部溶解生成NaAlO2、(1分)完全生成沉淀Mg(OH)2,(1分)
(4)7∶1 (2分)
【解析】(1)氯化镁和氯化铝都能和氢氧化钠反应生成白色沉淀,方程式分别是Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓。由于氢氧化铝是两性氢氧化物,能溶解在氢氧化钠中,所以DC段的反应是Al(OH)3+OH-=AlO2-+2H2O。
(2)根据图像可知,C点对应的沉淀是氢氧化镁,物质的量是0.2mol。D点对应的沉淀是氢氧化铝和氢氧化镁的混合物,共计是0.3mol,所以氢氧化铝是0.1mol,因此原溶液中Mg2+、Al3+物质的量浓度之比为2∶1。
(3)共计方程式可知,生成氢氧化镁和氢氧化铝消耗的氢氧化钠分别是0.4mol和0.3mol,溶解氢氧化铝消耗的氢氧化钠是0.1mol,因此共计是0.8mol氢氧化钠。所以图中线段OA∶AB=7∶1。


科目:高中化学 来源: 题型:
 Ⅰ用元素符号或化学式回答原子序数11~18的元素的有关问题:
Ⅰ用元素符号或化学式回答原子序数11~18的元素的有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
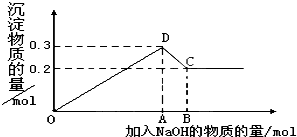 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如图所示.则:
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如图所示.则:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com