
某种药物合成中间体的结构简式为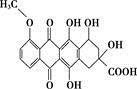 ,有关该物质的说法不正确的是( )
,有关该物质的说法不正确的是( )
A. 属于芳香族化合物
B. 能发生消去反应和酯化反应
C. 能分别与金属Na、NaHCO3溶液反应
D. 1 mol该有机物与足量Na2CO3溶液反应,消耗5 mol Na2CO3
科目:高中化学 来源:2016-2017学年辽宁省鞍山市高一3月月考化学试卷(解析版) 题型:选择题
两气体A和B的摩尔质量之比为2:1,则它们在同温、同压、同体积时的分子个数比应为
A. 1:1 B. 1:2 C. 2:1 D. 4:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市高二第二次(3月)学业水平模拟测试化学试卷(解析版) 题型:选择题
反应2CO2+6H2 CH2=CH2+4H2O可用于合成烯烃。下列有关说法错误的是
CH2=CH2+4H2O可用于合成烯烃。下列有关说法错误的是
A. 增大压强可加快该反应速率
B. 升高温度能加快该反应速率
C. 增大H2的浓度能加快该反应速率
D. 密闭容器中,通入略过量的CO2可以实现H2的100%转化
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长白山市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
有机物C4H8Cl2的结构中只含有一个甲基的同分异构体有几种(不考虑立体结构)
A. 8 B. 7 C. 4 D. 3
查看答案和解析>>
科目:高中化学 来源:2017届江西省新余市高三下学期第七次模拟考试理综化学试卷(解析版) 题型:填空题
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
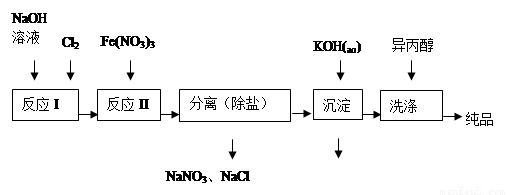
①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5mol/L,则需要调整 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省潍坊市高一下学期第一次月考模拟测试化学试卷(解析版) 题型:推断题
现有几种元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 失去一个电子后,形成Ne原子电子层结构 |
X | 短周期非金属,其最外层电子数是次外层电子数的一半 |
Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
Z | 形成双原子单质分子,黄绿色气体 |
(1)工业制备X单质反应的化学方程式_______________________________;
(2)画出T的离子结构示意图__________;
(3)写出实验室利用浓盐酸和二氧化锰制取单质Z的离子方程式______________________;
(4)由T和Y两种元素组成的一种阴阳离子个数比为1:2的过氧化物,其电子式为___________。写出该物质的一种用途__________________________________
(5)T、Z的最高价氧化物对应的水化物相互反应的离子方程式为___________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省潍坊市高一下学期第一次月考模拟测试化学试卷(解析版) 题型:选择题
9.2g金属钠投入到足量的重水中,则产生的气体中含有
A. 0.2mol中子 B. 0.4mol电子 C. 0.2mol质子 D. 0.4mol分子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省潍坊市高一下学期第一次月考模拟测试化学试卷(解析版) 题型:选择题
关于合金性质的说法中,错误的是( )
A. 合金的硬度一般比其各成分金属的硬度高
B. 合金的熔点一般比其各成分金属的熔点低
C. 合金的物理性质一般与其各成分金属的的物理性质不同
D. 合金的化学性质一般与其各成分金属的的化学性质不同
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第五次模拟考试理综化学试卷(解析版) 题型:简答题
硒(Se),是一种非金属元素。可以用作光敏材料、电解锰行业催化剂、动物体必需的营养元素和植物有益的营养元素等。请回答下列问题:
(1) Se原子的核外电子排布式为____________。
(2) 比较As的第一电离能比Se______(填“大”或“小”)。
(3) SeO42-中Se-O的键角比SeO3的键角____(填“大”或“小”)原因是______________
(4) H2SeO4比H2SeO3水溶液的酸性___________。
(5) 硒单质是红色或灰色粉末,带灰色金属光泽的准金属,灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如下。
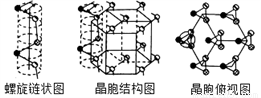
螺旋链中Se原子的杂化方式为__________。己知正六棱柱的边长为acm,高为b cm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的Se原子个数为_________,该晶体的密度为___________g/cm3 (用含NA、a、b的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com