
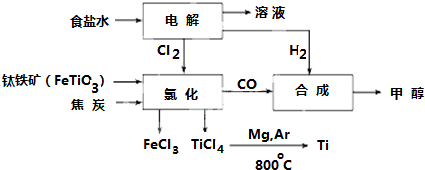
分析 (1)铁为过渡金属元素,位于周期表第四周期Ⅷ元素;
(2)钛铁矿在高温下与焦炭经氯化得到四氯化钛,还生成氯化铁、CO.
解答 解:(1)铁为过渡金属元素,位于周期表第四周期Ⅷ元素,故答案为:四;Ⅷ;
(2)钛铁矿在高温下与焦炭经氯化得到四氯化钛,还生成氯化铁、CO,该反应为2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO,
故答案为:2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO.
点评 本题以物质的分离提纯流程考查化学反应、物质的分离方法及原子结构等,侧重学生分析能力及知识迁移应用能力的考查,注意习题中的信息及数据处理题目难度中等.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=1mol•L-1 | B. | n(Na+)=3mol | C. | c(SO42-)=2mol•L-1 | D. | m(Na2SO4)=142g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 说明原溶液中一定含有FeCl3 | |
| B. | H3PO3+2NaOH(足量)=Na2HPO3+2H2O,H3PO3属于三元酸 | |
| C. | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀酸雨中一定含有SO42- | |
| D. | CaO$\stackrel{H_2{O}}{→}$Ca(OH)2$\stackrel{Na_{2}CO_{3}}{→}$NaOH 用生石灰制备NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A. | 该反应为放热反应 | |
| B. | 可测量容器总压变化来判定化学反应是否达到平衡 | |
| C. | 若在某平衡状态时,c(CO2)×c(H2)=c(CO)×c(H2O),此时的温度为830℃ | |
| D. | 达平衡时,浓度:c(CO2)=c(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳及其含碳化合物在人们的生产生活中应用广泛.
碳及其含碳化合物在人们的生产生活中应用广泛.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO2 | H2 | H2 | C2H5OH | |||
| 1 | 650 | 2 | 6.8 | 2.0 | 0.8 | 6 |
| 2 | 900 | 2 | 4.4 | 2.0 | 0.4 | 3 |
| 3 | 900 | 4 | 8.8 | C | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com