
分析 氯化亚铁与氢氧化钠溶液反应生成氢氧化亚铁沉淀和氯化钠,所以有白色沉淀生成;氢氧化亚铁不稳定,易被空气中氧气氧化,则白色沉淀迅速变成灰绿色,最终变成红褐色.
解答 解:用一只长滴管,深入液面下,向盛有FeCl2溶液的试管中滴加NaOH溶液,发生反应:Fe2++2OH-=Fe(OH)2↓,可观察到有白色沉淀生成;
Fe(OH)2易被空气中氧气氧化,则在空气中放置后白色沉淀迅速变为灰绿色,最后变为红褐色,
故答案为:Fe2++2OH-=Fe(OH)2↓; 白色沉淀迅速变为灰绿色最后变为红褐色.
点评 本题考查了离子方程式书写、铁及其化合物性质,题目难度不大,明确氢氧化亚铁的性质为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离方程式:H2CO3?2H++CO32- | |
| B. | 碱性氢氧燃料电池负极的电极反应式:H2-2e-=2H+ | |
| C. | HCO3-的水解方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | 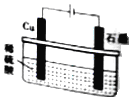 如图所示,反应开始时的离子方程式:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
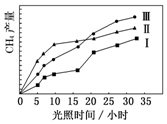 利用光能和光催化剂,可将 CO2 和 H2O(g)转化为 CH4 和 O2.紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示.
利用光能和光催化剂,可将 CO2 和 H2O(g)转化为 CH4 和 O2.紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 稀释浓盐酸过程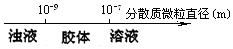 | |
| B. | 向氯化铝溶液中滴加氢氧化钠溶液至过量 | |
| C. | 分散系的分类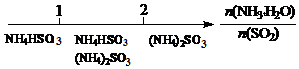 | |
| D. | 氨水与SO2反应后溶液中的铵盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3与BaCl2溶液作用,有白色沉淀生成,加稀HNO3后沉淀消失 | |
| B. | 将SO2气体分别通入Ba(OH)2溶液、FeCl3与BaCl2的混合溶液、HNO3酸化的BaCl2溶液中,均可有白色沉淀生成 | |
| C. | 将SO2气体通入BaCl2溶液中没有白色沉淀生成,将SO2气体通入Ba(NO3)2溶液中有白色沉淀生成 | |
| D. | 将SO2气体、Cl2一起通入BaCl2溶液中,或将SO2气体、NO2气体一起通入BaCl2 溶液中,均有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
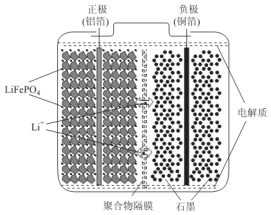
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃、水泥、水晶项链都是硅酸盐制品 | |
| B. | 晶体硅是在通信工程中制作光导纤维的主要原料 | |
| C. | 碳酸钠在医疗上是治疗胃酸过多的一种药剂 | |
| D. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 元素性质或原子结构 |
| X | X的某一种原子没有中子 |
| Y | 最高正价与最低负价的代数和为0 |
| Z | 最外层电子数是周期数的3倍 |
| M | 含M元素的物质,其焰色反应为黄色 |
| G | G的简单离子半径在同周期中最小 |
| A. | X是组成有机物的必需元素 | |
| B. | Y、Z所形成的氢化物分子均含有10个电子 | |
| C. | Z的简单离子半径大于G的简单离子半径 | |
| D. | G的氧化物不溶于M的最高价氧化物所对应的水化物的水溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com