
| A. | 食醋的主要成分是醋酸,它是一种弱酸 | |
| B. | 苯酚有毒,但可用于杀菌消毒 | |
| C. | 聚乙烯塑料制品可用于食品的包装 | |
| D. | 福尔马林可作食品的保鲜剂 |
分析 A.食醋为醋酸的水溶液,醋酸在水中不能完全电离;
B.苯酚有毒,且能使蛋白质发生变性;
C.聚乙烯无毒,为高分子材料;
D.福尔马林为甲醛的水溶液,HCHO有毒,且能使蛋白质发生变性.
解答 解:A.食醋为醋酸的水溶液,醋酸在水中不能完全电离,存在电离平衡,则食醋的主要成分是醋酸,它是一种弱酸,故A正确;
B.苯酚有毒,且能使蛋白质发生变性,可用于医疗中作消毒,或在药皂中使用,故B正确;
C.聚乙烯无毒,为高分子材料,则聚乙烯塑料制品可用于食品的包装,故C正确;
D.福尔马林为甲醛的水溶液,HCHO有毒,且能使蛋白质发生变性,可用于生物标本的防腐,但不能作食品的保鲜剂,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的性质、性质与用途、化学与生活等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HClO4>H2SO4>H3PO4 | B. | 离子半径:Na+>Mg2+>Al3+>F- | ||
| C. | 热稳定性:HCl>H2S>PH3>SiH4 | D. | 熔点:SiO2>NaCl>I2>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F 是前四周期原子电子轨道表示式中单电子数最多的元素 |
| G在周期表的第十一列 |
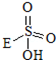 →
→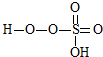 +HE (请写出横线上物质的结构式)
+HE (请写出横线上物质的结构式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si→SiO2→H2SiO3→Na2SiO3 | B. | Na→Na2O2→Na2CO3→NaCl | ||
| C. | Fe→FeCl3→Fe(OH)3→Fe2O3 | D. | Al→Al2O3→AlCl3→Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质熔沸点的高低顺序是:晶体硅>氯化钠>干冰>汞 | |
| B. | 分子晶体中一定存在分子间作用力 | |
| C. | 水是一种非常稳定的化合物,这是由于氢键所致 | |
| D. | CO2、HCl、CF4、PCl3四种物质分子中的所有原子都满足最外层为8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
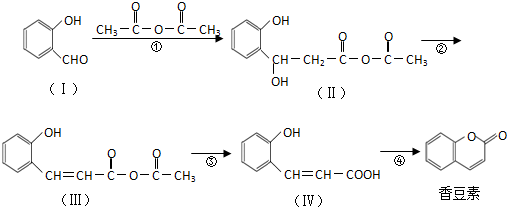
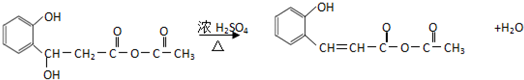 .
.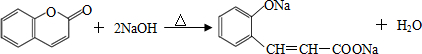 .
. (任意2种)(任写两种).
(任意2种)(任写两种).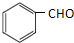 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H3PO4>H2SiO3 | B. | 还原性:Na>Mg>Al | ||
| C. | 稳定性:HF>HCl>HBr | D. | 原子半径:Cl>S>O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
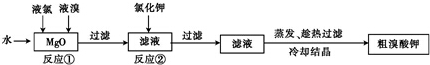
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:正戊烷>2-甲基丁烷>乙烷 | B. | 同分异构体种类:戊烯<戊烷 | ||
| C. | 密度:苯<水<硝基苯 | D. | 含碳量:乙烯>乙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com