
| A、当电池负极消耗m g气体时,电解池阴极同时有m g气体生成 |
| B、电池的正极反应式为:O2+2H2O+4e-═4OH- |
| C、电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| D、燃料电池中c(KOH)不变 |
| m |
| 2 |
| m |
| 2 |


科目:高中化学 来源: 题型:
| A、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| C、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D、验证烧碱溶液中是否含有Cl-,先加稍过量的稀硝酸除去OH-,再加入AgNO3溶液,如有白色沉淀,则证明有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加少量水,更多的氢氧化镁溶解 |
| B、加少量NaOH(s),氢氧化镁的溶解量减少 |
| C、加少量氯化氢,溶液的pH变大 |
| D、加少量MgCl2(s),溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
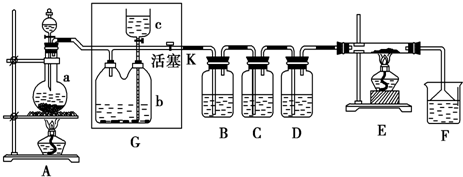
查看答案和解析>>
科目:高中化学 来源: 题型:
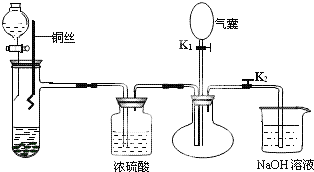
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 L 0.1 mol?L-1 K2SO4溶液中离子所带电荷总数约为0.6 NA |
| B、标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的原子总数均为2NA |
| C、1 mol Cl2变为Cl-时得到的电子数为NA |
| D、由质量守恒定律可知1mol的氯化铁能形成NA个氢氧化铁胶体粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com