
����Ŀ����������ۺ����������ڽ�Լ��Դ������������ʵ�������÷Ͼɵ�ص�ͭñ��Cu��Zn�ܺ���ԼΪ99%���Ʊ�ZnCl24H2O��CuCl22H2O�IJ���ʵ�鲽����ͼ��
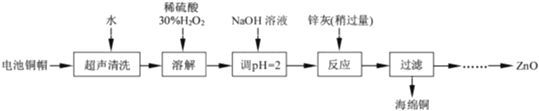
��1��������Һ��������ȡZnCl24H2O��ʵ�鲽������Ϊ_____��_____�����ˡ���ˮϴ�ӡ����¸���
��2�����ܽ���������У�������Ӧ�����ӷ���ʽΪ_____
��3���Ȼ�ͭ��Һ�и���ͭ���ֵķֲ�������c��Cl�����Ĺ�ϵ��ͼ��
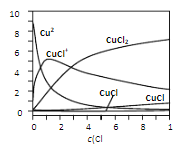
�ٵ�c��Cl������9molL��1ʱ����Һ����Ҫ��3�ֺ�ͭ����Ũ�ȴ�С��ϵΪ_____
����c��Cl������1molL��1���Ȼ�ͭ��Һ�У�����AgNO3��Һ�����ɰ�ɫ���������ӷ���ʽΪ_____����дһ������
��4��Ϊ�ⶨ��Ʒ����CuCl22H2O���Ĵ��ȣ���ȡ0.90g��Ʒ������ϡ���Ტ���250mL��Һ��ȡ25.00mL��Һ����ƿ�У����������KI��ַ�Ӧ������������μ���0.02000 molL��1 Na2S2O3��Һ���պ���ȫ��Ӧ������Na2S2O3��Һ2500mL����֪��2Cu2++4I����2CuI����ɫ����+I2��2S2O32��+I2�T2I��+S4O62��
����Ʒ�����Һʱ��Ҫ�IJ����������ձ�����ͷ�ι��⣬����Ҫ_____��_____
��������ʵ�����ݼ�����Ʒ��CuCl22H2O������������д��������̣�______________
���𰸡�����Ũ�� ��ȴ�ᾧ Cu+H2O2+2H+��Cu2++2H2O c��CuCl2����c��CuCl+����c��CuCl3���� Ag++Cl����AgCl�� ������ 250mL����ƿ 95%
��������
�������̣��Ͼɵ�ص�ͭñ��Cu��Zn�ܺ���ԼΪ99%����ϡ�����ܽ�Zn�����ˣ���ҺIΪ�Ȼ�п������ΪCu������˫��ˮ�������ܽ�õ��Ȼ�ͭ������Ũ������ȴ�ᾧ�õ�CuCl22H2O��
��1����ҺIΪ�Ȼ�п��Һ����������Ũ������ȴ�ᾧ�����ˡ���ˮϴ�ӡ����¸���õ�ZnCl24H2O���ʴ�Ϊ������Ũ������ȴ�ᾧ��
��2�����ܽ����������Ϊ����������ϡ�����������ܽ�ͭ���õ��Ȼ�ͭ��ˮ����ӦΪ��Cu+H2O2+2H+��Cu2++2H2O���ʴ�Ϊ��Cu+H2O2+2H+��Cu2++2H2O��
��3������c��Cl������9molL��1������һ��ƽ������������ߣ��ɼ���Һ����Ҫ��ͭ����Ũ�ȴ�С��ϵΪ��c��CuCl2����c��CuCl+����c��CuCl3������c��Cu2+����c��CuCl42�������ʴ�Ϊ��c��CuCl2����c��CuCl+����c��CuCl3������
�ڴ�ͼ�Ͽɼ�����c��Cl������1molL��1���Ȼ�ͭ��Һ�У�����AgNO3��Һ���������������������Ȼ�����ɫ��������ӦΪ��Ag++Cl����AgCl�����ʴ�Ϊ��Ag++Cl����AgCl����
��4��������250mL��Һ��Ҫ�IJ����������ձ�������ιܡ���������250ml����ƿ���ʴ�Ϊ����������250mL����ƿ��
�ڸ��������У�2Cu2+��I2��2Na2S2O3����n��Cu2+����n��Na2S2O3����0.02000mol/L��0.025L��
����Ʒ��m��CuCl22H2O����0.02000mol/L��0.025L��![]() ��171g/mol��0.855g����Ʒ��CuCl22H2O����������Ϊ��
��171g/mol��0.855g����Ʒ��CuCl22H2O����������Ϊ��![]() ��95%���ʴ�Ϊ��95%��
��95%���ʴ�Ϊ��95%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ʯ����ܶ࣬���ͭ��ú���̿���п��ȣ���ش��������⣺
��l����ͭ�����Ҫ�ɷ�Ϊ��������ͭ��CuFeS2������̬Cu2+����Χ�����Ų�ͼΪ ______��Fe2+���� ___��δ�ɶԵ��ӡ�
��2��Mn�ĵ��������ܱ�Fe�ĵ��������ܴ��ԭ��Ϊ ___��
��3��ú�����ɵð����������ױ��Ȳ�Ʒ�����Ŀռ乹��Ϊ ___���ױ������ϼ���̼ԭ�ӵ��ӻ���ʽΪ____�������黯���NH3BH3����һ�����ͻ�ѧ�⻯�ﴢ����ϣ�������ĽṹʽΪ____����λ������������ʾ�����백���黥Ϊ�ȵ�������л�С����Ϊ_____д���ƣ���
��4���ڻ�п�ľ����ṹ��ͼ1��ʾ��
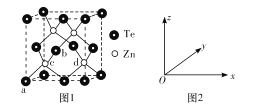
���ڻ�п�Ļ�ѧʽΪ____��
��ͼ2�ɱ�ʾ�����ڲ���ԭ�ӵ����λ�ã���֪a��b��c��ԭ����������ֱ�Ϊ��0��0��0������![]() ��0��
��0��![]() ������
������![]() ��
��![]() ��
��![]() ������d��ԭ���������Ϊ____
������d��ԭ���������Ϊ____
�����������������Teԭ�Ӽ����Ϊapm�������ӵ�����ֵΪNA�������ܶ�Ϊ____g/cm3���ú���NA��a�Ĵ���ʽ��ʾ�����ػ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����
A.������(������Ƥ)�Ʋ���������Բ���ʴ
B.CH3Cl(g)��Cl2(g)![]() CH2Cl2(l)��HCl(g)���Է����У���÷�Ӧ����H��0
CH2Cl2(l)��HCl(g)���Է����У���÷�Ӧ����H��0
C.MnS����Һ�еμ�����CuSO4��Һ������CuS��������Ksp(CuS)< Ksp(MnS)
D.�ϳɰ������н�NH3Һ�����룬һ���ܼӿ�����Ӧ���ʣ����H2��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧʵ���г������Ʊ����岢����ijЩ���ʵļ��������ʵ���װ�ã�A���Ʊ������װ�ã�C��D��E��F��ʢװ��Һ�������ͬ��Ҳ���ܲ�ͬ���Իش�
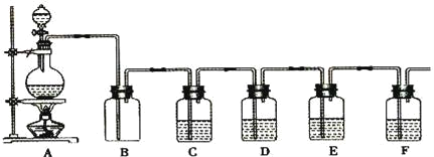
��1�����A�еĹ���������̼����Һ©����ʢװ����Ũ���ᣬ��д�������Ļ�ѧ��Ӧ����ʽ��____����Ҫ�������ɵIJ����B��C��D��E��F��Ӧ�ֱ������Լ�Ϊ__��__��__��__��__��E���Լ���C����ͬ��E���Լ����������__��Bװ�ó��ɼ��ij�����⣬������__���á�
��2������������ʵ��ʱ��F�еõ�10.0 g���壬��A�з�����Ӧת�Ƶĵ�����Ϊ__����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��C������ȣ�����ᷢ���ۻ�������ش��������⣺
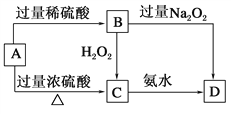
(1)A��________�����ƶϵ�������___________________��
(2)B��������������H2O2��Ӧ�����ӷ���ʽ��_____________________��
(3)A�����ŨH2SO4��Ӧ�Ļ�ѧ����ʽ��_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��/mol��L-1 | 0.1 | 0.2 | 0 |
ƽ��Ũ��/mol��L-1 | 0.05 | 0.05 | 0.1 |
����˵��������ǣ�
A. ��Ӧ�ﵽƽ��ʱ��X��ת����Ϊ50�� B. ��Ӧ�ɱ�ʾΪX+3Y![]() 2Z����ƽ�ⳣ��Ϊ1600 C. ����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������ D. �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
2Z����ƽ�ⳣ��Ϊ1600 C. ����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������ D. �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ��������ϸ������Ʒ����Ҫ�м��壬�乤ҵ�Ʊ�ԭ����ͼ1����Pd/Al2O3Ϊ����������ͬ��Ӧʱ���ڣ���ò�ͬ�¶��£�����������ͬ�������ϩת�����뻷��ϩ���ʵı仯������ͼ2������˵����ȷ���ǣ���
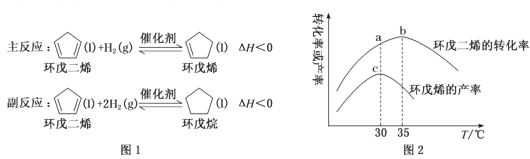
A.�����ϩ��ת����Խ��Խ�����ڻ���ϩ������
B.a��������Ӧ��ƽ��ת���ʣ�b���Ǹ���Ӧ��ƽ��ת����
C.30�桫35��֮�价��ϩ���ʱ仯�����뻷���ϩת���ʲ�һ�£�ԭ��������Ӧ�����ƣ�ʹ����ϩ���ʽ���
D.30��ʱ������ѡ������ã�������������ɻ���ϩ��ƽ��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ���ͬ��X��Y���ܱ�������X�г���CO���壬Y�г���CH4��O2��N2�Ļ�����壬ͬ��ͬѹ�²���������������ܶ���ͬ�����������в���ȷ����
A.Y������CH4��O2��N2������֮�ȿ���Ϊ1��6��3
B.Y������CH4��O2��N2�����ʵ���֮��һ��Ϊ1��3��6
C.���������������������һ����ͬ
D.���������������������һ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�ػ��ϼۺ�������������Ƕ�ѧϰ���о����ʵ����ʣ���һ����֮��Ч�ķ����������ǵ�Ԫ���γ����ʵļ����άͼ�ļ�����ѭ���IJ�����Ϣ��
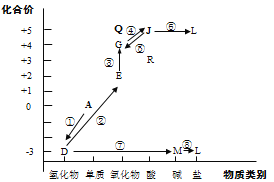
��1������һ���˹��̵�����Ҫ;�����÷�Ӧ�Ļ�ѧ����ʽ��__________��
��2���ڵĻ�ѧ����ʽ��__________��
��3���ݵĻ�ѧ����ʽ�ǣ���дһ�֣�__________��
��4��R���� NaOH��Һ��Ӧ��HNO2+NaOH=NaNO2+H2O���÷�Ӧ������R��HNO2����_____�ԡ�
��5��Q�Ļ�ѧʽ��_______��Q�������������д��Q��ˮ��Ӧ�Ļ�ѧ����ʽ________��
��6��L��ˮ���й�������ᵼ��ˮ�帻Ӫ��������ˮ�����Ϊ���Ժ��������NaClO���ɽ�L��������ת��Ϊ����Ⱦ������ȥ����д��L��NaClO��Ӧ�����ӷ���ʽ_________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com