
| A. | Na2SO3的水解:SO32-+2H2O?H2SO3+2OH- | |
| B. | NaHCO3的电离:NaHCO3?Na ++H++CO32- | |
| C. | 钢铁发生吸氧腐蚀的负极反应式:4OH-+4e-=H2O+O2↑ | |
| D. | 用惰性电极电解饱和食盐水时,阳极的电极反应式:2Cl--2e-=Cl2↑ |
分析 A、多元弱酸根的水解是分步完成;
B、NaHCO3的电离:NaHCO3=Na ++HCO3-;
C、钢铁发生吸氧腐蚀的负极,是铁发生氧化反应,正极是氧气得电子,反应式:4OH-+4e-=H2O+O2↑;
D、电解池阳极发生氧化反应.
解答 解:A、多元弱酸根的水解是分步完成,所以Na2SO3的水解反应方程式为:SO32-+H2O?HSO3-+OH-,故A错误;
B、NaHCO3的电离:NaHCO3=Na ++HCO3-,故B错误;
C、钢铁发生吸氧腐蚀的负极,是铁发生氧化反应,正极是氧气得电子,反应式:4OH-+4e-=H2O+O2↑,而负极反应式为:Fe-2e-=Fe2+,故C错误;
D、电解池阳极发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,故D正确;
故选D.
点评 本题考查盐的水解和电离反应方程式的书写和电化学的相关知识,学生成要清楚多元弱酸根离子的水解是分步完成,而不是一步完成,综合性强,有一定的难度.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:2017届贵州省高三上第四次模拟化学试卷(解析版) 题型:填空题
【化学-选修3:物质结构与性质】
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是______________,基态铜原子的核外电子排布式为________________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____________(填晶体类型)。
(3)CO和CO的一种生活中常见等电子体分子,两者相比较沸点较高的为__________(填化学式)。CN-中碳原子杂化轨道类型为_______________,C、N、O三元素的第一电离能最大的为_______________(用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图1所示。每个铜原子周围距离最近的铜原子数目__________。
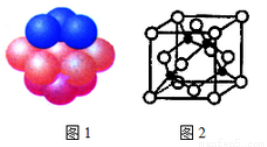
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(黑点代表铜原子)。
①该晶体的化学式为_____________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于________________(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,已知该晶体中铜原子和M原子之间的最短距离为体对角线的1/4,则该晶体中铜原子和M原子之间的最短距离为_______________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH | B. | HOOC-COOH | C. | 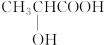 | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s12s1 | B. | 1s22s12p1 | C. | 1s22s22p63s2 | D. | 1s22s22p63p1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸不反应 |
| C | 向AlCl3溶液中滴加过量NaOH溶液 | 溶液澄清 | Al3+与NaOH能大量共存 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com