
| A. | 等浓度NaHSO4和Ba(OH)2两溶液等体积混合H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 在含有Mn2+的溶液中加入稀硝酸酸化,再加入PbO2反应体系显紫红色5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O | |
| C. | 硫酸亚铁溶液中加入过氧化氢溶液:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| D. | Na2O2投入H218O中:2H218O+2Na2O2═4Na++4OH-+18O2↑ |
分析 A.等浓度、等体积的两溶液中含有溶质的物质的量相等,反应生成硫酸钡沉淀、水、氢氧化钠;
B.酸性条件下二氧化铅将锰离子氧化成高锰酸根离子;
C.双氧水具有氧化性,能够将亚铁离子氧化成铁离子;
D.Na2O2加入到足量H218O中,过氧化钠既做氧化剂又做还原剂,18O转化到部分氢氧根离子中.
解答 解:A.等浓度NaHSO4和Ba(OH)2两溶液等体积混合,氢氧根离子过量,反应生成硫酸钡沉淀、水和氢氧化钠,反应的离子方程式为:H++SO42-+Ba2++OH-═BaSO4↓+H2O,故A正确;
B.在含有Mn2+的溶液中加入稀硝酸酸化,再加入PbO2反应生成高锰酸根离子,溶液显紫红色,反应的离子方程式为:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O,故B正确;
C.硫酸亚铁溶液中加过氧化氢溶液,亚铁离子被氧化成铁离子,反应的离子反应为:2Fe2++H2O2+2H+═2Fe3++2H2O,故C正确;
D.Na2O2加入到足量H218O中,过氧化钠既做氧化剂又做还原剂,正确的离子方程式:2Na2O2+2H218O═4Na++2OH-+218OH-+O2↑,故D错误;
故选D.
点评 本题考查了离子方程式书写方法,题目难度不大,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循电荷守恒规律,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 金属熔点的高低 | B. | 金属阳离子得电子的能力 | ||
| C. | 金属在自然界的存在形式 | D. | 金属元素在地壳中的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2,2ClO-+CO2+H2O═2HClO+CO32- | |
| B. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO3-═3Br2+2NO↑+4H2O | |
| C. | 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7,Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 双氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2═2Mn2++5O2↑+6OH-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯酸所有原子可能共平面 | |
| B. | 丙烯酸可以发生取代反应 | |
| C. | 丙烯酸可以使酸性高锰酸钾溶液褪色 | |
| D. | 丙烯酸与HBr发生加成反应只能得到唯一产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
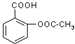 试根据阿斯匹林的结构回答;
试根据阿斯匹林的结构回答; ,其分子式为C7H6O3,则B的结构简式为CH3COOH;
,其分子式为C7H6O3,则B的结构简式为CH3COOH;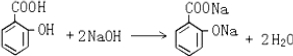 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com