
| A. |  | B. |  | C. |  | D. |  |
分析 垃圾回收标志:外面是一个可循环的三角形轮廓,三角形里面可用不同数字代表不同材料,也可无数字,据此结合各个标志所代表的含义分析解答.
解答 解:A.图形由中心的青山、绿水、太阳及周围的十个环组成,图形的中心结构表示人类赖以生存的环境,外围的十个环紧密结合,环环紧扣,表示公众参与,共同保护环境,是中国环境标志,故A错误;
B.图中所示标志上方的太阳、下方的叶片和中间的蓓蕾,象征自然生态,是绿色食品标志,故B错误;
C.手的掌心有一滴水,寓意是世界上剩下的最后一滴水将是人的眼泪,是节水标志,故C错误;
D.图中所示标志特点是一个可循环的三角形轮廓,是垃圾可回收标志,故D正确;
故选D.
点评 本题考查常见标志所代表的含义,了解垃圾的分类知识、各个标志所代表的含义是正确解答本题的关键,题目难度不大,注意相关知识的积累.


科目:高中化学 来源: 题型:选择题

| A. | a是锌,b是铜,c是硫酸溶液 | B. | a是铁,b是银,c是硝酸银溶液 | ||
| C. | a是银,b是铁,c是硝酸银溶液 | D. | a是铁,b是碳,c是氯化铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下都是晶体 | B. | 最外层电子数少于3个的都是金属 | ||
| C. | 都能导电、传热 | D. | 都只能和酸不能和碱发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如下装置(夹持装置略,气密性已检验):
氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如下装置(夹持装置略,气密性已检验):查看答案和解析>>
科目:高中化学 来源: 题型:解答题

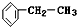 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$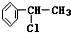 +HCl;②
+HCl;②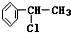 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$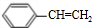 +NaCl+H2O;
+NaCl+H2O;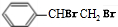 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$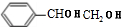 +2NaBr;⑤2
+2NaBr;⑤2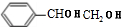 +O2$→_{△}^{Cu或Ag}$2
+O2$→_{△}^{Cu或Ag}$2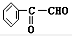 +2H2O;
+2H2O;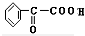 +H2$→_{△}^{Ni}$2
+H2$→_{△}^{Ni}$2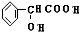 ;⑧n
;⑧n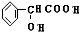 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$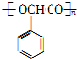 +nH2O.
+nH2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
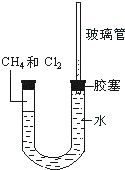 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:1)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:1)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
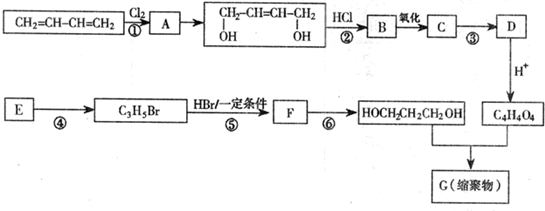
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3:1 | B. | 1:3:2 | C. | 2:3:3 | D. | 3:2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com