
| ʱ�䣨min�� | 1 | 2 | 3 | 4 | 5 |
| ���������mL�� | 50 | 120 | 232 | 290 | 310 |
���� ��1���ȼ���ÿ��ʱ��ε����������Ȼ�������ͬ�����£���������뷴Ӧ���ʵĹ�ϵ�жϷ�Ӧ���ʴ�С�����ݸ÷�Ӧ�������仯�Ĺ�ϵ�ж����ʱ仯ԭ��
��2���������������ʵ�����Ȼ���������仯�����ʵ������������ʹ�ʽ���㼴�ɣ�
��3������Ũ�ȡ�����ʵ�ǿ���Է�Ӧ���ʵ�Ӱ���жϣ�
��� �⣺0��1 min��1��2 min��2��3 min��3��4 min��4��5min����ʱ��ε���������ֱ�Ϊ��50 mL��70mL��112 mL��58 mL��20 mL��
��1������ͬͨ�����£���Ӧ����Խ����ͬʱ�����ռ�������Խ�ࣻ������ã���Ӧ��������ʱ�����2��3 min����ԭ���ǣ��÷�Ӧ�Ƿ��ȷ�Ӧ���¶�Խ�ߣ���Ӧ����Խ��
�ʴ�Ϊ��2��3 min���÷�Ӧ�Ƿ��ȷ�Ӧ���¶����ߣ���Ӧ���ʼӿ죻
��2��2��3 min���������������112 mL������Ҫ��������ʵ���Ϊxmol��
Zn+2HCl=ZnCl2 +H2 ��
2 mol 22.4L
xmol 0.112L
��x=0.01
����v��HCl��=$\frac{\frac{��n}{V}}{��t}$=0.1mol/��L��min��
�ʴ�Ϊ��0.1mol/��L��min����
��3���ı仯ѧ��Ӧ���ʵķ����У��ı���Һ��Ũ�ȡ��ı���Һ���¶ȡ��ı����ı�����ȣ�
A��������ˮ����Һ���������Ũ�Ƚ��ͣ���Ӧ���ʼ�С�������ɵ�����������䣬��A��ȷ��
B����NaCl��Һ����Һ���������Ũ�Ƚ��ͣ���Ӧ���ʼ�С�������ɵ�����������䣬��B��ȷ��
C����Na2CO3��Һ����Һ��������������Ũ�Ƚ��ͣ��������̼���Ʒ�Ӧ���ɶ�����̼������������С����C����
D����CuSO4��Һ�����γ�ͭпԭ��أ��ӿ췴Ӧ���ʣ���D����
��ѡAB��
���� ������Ҫ���黯ѧ��Ӧ���ʵ�Ӱ�����أ���Ŀ�Ѷ��еȣ���Ҫע����Ƿ�Ӧ������Ũ���Լ��¶ȵı仯����ȷ��ѧ��Ӧ���ʵĸ�����㷽����ע�ػ���֪ʶ�Ļ��ۣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ij�ܱ�����ʢ��0.1molN2��0.3molH2����һ�������³�ַ�Ӧ��ת�Ƶ��ӵ���ĿΪ0.6NA | |
| B�� | ��״���£�22.4L��CCl4�к��е�CCl4������ΪNA | |
| C�� | 4��ʱ��18g 2H216O�к��й��õ��Ӷ���Ϊ2NA | |
| D�� | �����£�4gCH4����NA ��C-H���ۼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H��D��T��ʾͬһ�ֺ��� | B�� | F-���ӽṹʾ��ͼ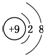 | ||
| C�� | ���������ʽ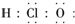 | D�� | �õ���ʽ��ʾHCl�γɹ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Ԫ�ر�� | Ԫ��������Ϣ |
| A | ��ԭ�Ӱ뾶��С��Ԫ�� |
| B | �����Ӵ�������λ����ɣ������ǿ�������Ҫ�ɷ�֮һ |
| C | �Ƕ�����Ԫ����ԭ�Ӱ뾶��������Ԫ�أ� |
| D | ����������������ﶼ�����ԣ���Cͬ���� |
| E | ��Cͬ���ڣ�ԭ�Ӱ뾶�ڸ�������С |
| F | ԭ�����������Ӳ㣬�����������������ڲ��������3���� |
 ��
��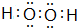 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
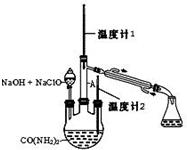 ˮ���� ��N2H4•H2O�� ��������ԭ���Ϳ����������۵�Ϊ-40�棬�е� 118.5�棬������ʵ����������װ����ȡˮ���£�N2H4•H2O���漰���з�Ӧ��
ˮ���� ��N2H4•H2O�� ��������ԭ���Ϳ����������۵�Ϊ-40�棬�е� 118.5�棬������ʵ����������װ����ȡˮ���£�N2H4•H2O���漰���з�Ӧ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com