
| A、电解氯化镁溶液:Mg2++2Cl-═Mg+Cl2↑ |
| B、碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
| C、酸性K2Cr2O7溶液可氧化双氧水H2O2:Cr2O72-+8H++5H2O2=2 Cr3++4O2↑+9H2O |
| D、氨水溶解氯化银沉淀的原理:AgCl+2 NH3?H2O=[Ag(NH3)2]++Cl-+2H2O |
| ||


科目:高中化学 来源: 题型:
| A、电解精炼铜时,若阴极得到电子数为2NA,阳极减少64g |
| B、200mL某硫酸强碱盐中含有1.5NA个SO42-离子,同时含有NA个金属阳离子,该盐物质的量浓度是2.5mol/L |
| C、常温常压下78g Na2O2固体中所含阴、阳离子总数为4NA |
| D、一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素周期表有7个主族,8个副族 |
| B、元素周期表有3个长周期、4个短周期 |
| C、第ⅢA族位于元素周期表的第三列(从左往右) |
| D、0族位于元素周期表的第18列(从左往右) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 温度T1>T2,SO2与O2反应过程中的能量变化 |
B、 表示0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/LCH3COOH溶液所得到的滴定曲线 |
C、 表示Zn、Cu和稀硫酸构成的原电池在工作过程中电流强度的变化,T时加入了H2O2 |
D、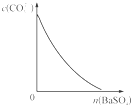 表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
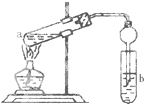 如图,在试管a中先加入3mL 95%的乙醇,边摇动边缓缓加入2mL浓H2SO4并充分摇匀,冷却后再加入2mL冰醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入3mL 95%的乙醇,边摇动边缓缓加入2mL浓H2SO4并充分摇匀,冷却后再加入2mL冰醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
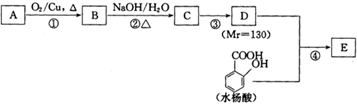
| NaOH/H2O |
| △ |
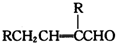
| 反应物1 |
| 反应条件1 |
| 反应物2 |
| 反应条件2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com