
已知反应4NH3(g)+5 O2 (g)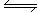 4NO (g)+6H2O (g)。回答下列问题:
4NO (g)+6H2O (g)。回答下列问题:
(1)在一定温度下,向一个5 L的密闭容器中充入0.20 mol的NH3和0.80 mol的O2,如反应初始6min内NH3的平均反应速率v(NH3)=0.003 mol·L-1·min-1,则6 min时c(O2)=___mol·L-1,NO的物质的量为________mol;反应一段时间后,达到平衡状态,如果这时向该密闭容器中再充入1 mol氩气,平衡时NH3的转化率________。(填“增大”“不变”或“减小”)
(2)判断该反应是否达到平衡的依据为________(填正确选项前的字母):a.体系压强不随时间改变 b.气体的密度不随时间改变 c.c(NH3)不随时间改变 d.单位时间里生成NO和H2O (g)的物质的量之比为4:6
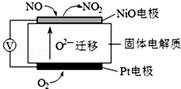 (3)氮的氧化物NOx是大气污染的主要污染物之一,通过NOx传感器可监测NOx的含量,其工作原理示意图如右:(工作原理和燃料电池类似)①Pt电极为 极(填正、负);NiO电极发生 反应(填“氧化”或“还原”).
(3)氮的氧化物NOx是大气污染的主要污染物之一,通过NOx传感器可监测NOx的含量,其工作原理示意图如右:(工作原理和燃料电池类似)①Pt电极为 极(填正、负);NiO电极发生 反应(填“氧化”或“还原”).
②写出NiO电极的电极反应式: .
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
一种碳纳米管能够吸附氢气,可作二次电池(如下图所示)的碳电极。该电池的电解质溶液为6 mol·L-1的KOH溶液。
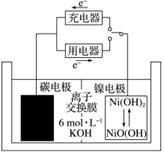
(1)写出放电时的正、负极电极反应式。
(2)写出充电时的阴、阳极电极反应式。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。SnSO4的实验室制备设计路线如下:
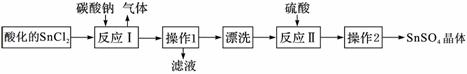
下列有关说法正确的是
A.SnCl2酸化是为了防止溶解时发生水解
B.反应I中发生的离子反应为:CO32-+2H+=CO2↑+ H2O
C.漂洗时,将固体置于烧杯中,加蒸馏水洗涤过滤2~3次
D.操作1为过滤,操作2为结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
下列材料都具有一定的特殊性能,其中是由长周期的主族元素和副族元素形成的是
| A、透明陶瓷材料硒化锌 | B、SO2和O2反应的催化剂五氧化二钒 |
| C、半导体材料砷化镓 | D、吸氢材料镧镍合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
①离子化合物一定含离子键,也可能含极性键或非极性键 ②共价化合物一定含共价键,也可能含离子键 ③含金属元素的化合物不一定是离子化合物 ④由非金属元素组成的化合物一定是共价化合物 ⑤由分子组成的物质中一定存在共价键 ⑥熔融状态能导电的化合物一定是离子化合物
A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)CH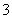 、—CH3(甲基)、CH
、—CH3(甲基)、CH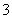 都是重要的有机反应中间体,有关它们的说法正确的是________。
都是重要的有机反应中间体,有关它们的说法正确的是________。
A.它们均由甲烷去掉一个氢原子所得
B.它们互为等电子体,碳原子均采取sp2杂化
C.CH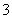 与NH3、H3O+互为等电子体,几何构型均为三角锥形
与NH3、H3O+互为等电子体,几何构型均为三角锥形
D.CH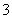 中的碳原子采取sp2杂化,所有原子均共面
中的碳原子采取sp2杂化,所有原子均共面
E.两个—CH3(甲基)或一个CH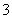 和一个CH
和一个CH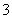 结合均可得到CH3CH3
结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌在周期表中的位置:第________周期第________族,属于________区。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。写出Zn2+基态电子排布式________________________________________________________________________;
葡萄糖分子[CH2OHCHOH(CHOH)3CHO]中碳原子杂化方式有________。
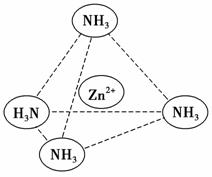
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配位体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的性质比较,正确的是( )
A.酸性:H2SO4>HClO4>HBrO4 B.碱性:NaOH>KOH>RbOH
C.非金属性: P>S>Cl D.气态氢化物稳定性:HF>H2O>PH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com