
【题目】在25°C时,向a mL 0.10mol·L-1的HNO2溶液中逐滴加入0.10mol·L-1的NaOH溶液,滴定过程中,混合溶液的pOH[pOH= -lgc(OH-)]与NaOH溶液的体积V的关系如图所示。已知P点溶液中存在c(OH-)=c(H+)+c(HNO2),下列说法不正确的是( )
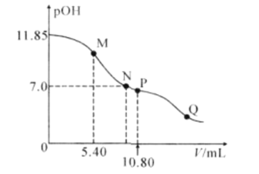
A.25°C时,HNO2电离常数的数量级是10-4
B.M点溶液中存在:3c(H+)+ c(HNO2)=3c(OH-)+ c(NO2-)
C.图上M、N、P、Q四点溶液中所含离子的种类相同
D.a=10.80
【答案】B
【解析】
已知P点溶液中存在c(OH-)=c(H+)+c(HNO2),同时溶液中存在电荷守恒:c(OH-)+c(NO2-)=c(H+)+c(Na+),二式联立可得:c(NO2-)+c(HNO2)=c(Na+),此为NaNO2溶液中的物料守恒式,即P点溶液中的溶质只有NaNO2,亚硝酸和氢氧化钠恰好完全反应,所以初始亚硝酸溶液的体积为10.80mL,据此分析作答。
A. HNO2的电离常数 ,未滴加氢氧化钠时,0.1mol/L的HNO2溶液的pOH=11.85,即溶液中c(OH-)=10-11.85mol/L,根据水的离子积可知c(H+)=10-2.15mol/L,溶液中存在电离平衡HNO2H++NO2-,溶液中氢离子浓度和亚硝酸根离子浓度大致相等,所以
,未滴加氢氧化钠时,0.1mol/L的HNO2溶液的pOH=11.85,即溶液中c(OH-)=10-11.85mol/L,根据水的离子积可知c(H+)=10-2.15mol/L,溶液中存在电离平衡HNO2H++NO2-,溶液中氢离子浓度和亚硝酸根离子浓度大致相等,所以![]() ,故25°C时,HNO2电离常数的数量级是10-4,故A正确;
,故25°C时,HNO2电离常数的数量级是10-4,故A正确;
B. 根据以上分析可知a=10.80,所以当加入5.40mL氢氧化钠溶液时溶液中的溶质为等物质的量的HNO2和NaNO2,存在电荷守恒:c(OH-)+c(NO2-)=c(H+)+c(Na+),存在物料守恒:c(NO2-)+c(HNO2)=2c(Na+),二式联立可得2c(H+)+c(HNO2)=2c(OH-)+c(NO2-),故B错误;
C. M、N、P、Q四点溶液中均含有:H+、OH-、NO2-、Na+,故四点溶液中所含离子的种类相同,故C正确;
D. 根据以上分析可知a=10.80,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】锂-铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电能,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是( )

A.该电池的负极为Li
B.通空气时,铜被腐蚀,表面产生Cu2O
C.放电时,正极的电极反应式为O2+2H2O+4e-=4OH-
D.若有1 mol Li+透过固体电解质时,标准状况下参与反应的O2体积为5.6 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法,化合物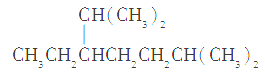 的名称为2,6二甲基-5-乙基庚烷
的名称为2,6二甲基-5-乙基庚烷
B.丙氨酸和苯丙氨酸脱水,最多可生成3种二肽
C.化合物 是苯的同系物
是苯的同系物
D.三硝酸甘油酯的分子式为C3H5N3O9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如图所示:
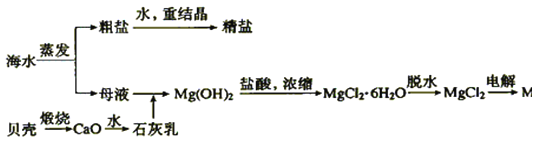
(1)写出下列反应的化学方程式。
①石灰乳与母液反应___;
②Mg(OH)2中加入盐酸的离子方程式:__;
③MgCl2![]() Mg:___。
Mg:___。
(2)在海水提取镁的过程中,没有涉及的化学反应类型__
A.分解反应 B.化合反应 C.复分解反应 D.置换反应 E.氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某教师设计了如图所示装置(夹持装置等已省略),其实验操作为:先按图安装好装置,关闭活塞a、b、c,在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,而有节奏(间歇性)地通入气体。在M处观察到明显的实验现象。试回答以下问题:
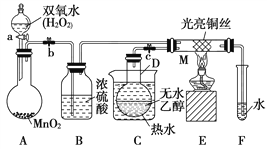
(1)写出A中发生反应的化学方程式:_____________________;B的作用是____________________;C中热水的作用是_________________________________________。
(2)写出M处发生反应的化学方程式为_________________________。
(3)从M管中可观察到的现象为_______________________,从中可认识到该实验过程中催化剂________(填“参加”或“不参加”)化学反应,还可以认识到催化剂起催化作用需要一定的________。
(4)实验进行一段时间后,如果撤掉酒精灯,反应________(填“能”或“不能”)继续进行,其原因是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、P、As等元素的化合物在生产和研究中有许多重要用途.请回答下列问题:
(1)意大利罗马大学的Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为______________________,N—N键的键角为______________________;
(2)基态砷原子的价电子排布图为______________________,砷与同周期相邻元素的第一电离能由大到小的顺序为______________________;
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。PH3与NH3的结构相似,和过渡金属更容易形成配合物的是____________________(填“PH3”或“NH3”)。
(4)SCl3+和PCl3是等电子体,SCl3+的空间构型是____________________;S—Cl键键长 ______P-Cl键键长(填“>”、“=”或“<”),原因是____________________。
(5)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,砷化镓的化学式为____________________。若该晶体的密度为ρg/cm3,设NA为阿伏加德罗常数的值,则a、b的距离为_________pm(用含ρ和NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CS(NH2)2(硫脲,白色而有光泽的晶体,溶于水,20℃时溶解度为13.6g;在150 ℃时转变成NH4SCN)是用于制造药物、染料、金属矿物的浮选剂等的原料。某化学实验小组同学用Ca(HS)2与CaCN2(石灰氮)合成硫脲并探究其性质。
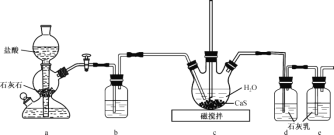
(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
①装置a中反应发生的操作为 _________;装置b中盛放的试剂是________ 。
②装置c中的长直导管的作用是________。
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱,合适的加热方式是__________;该反应的化学方程式为____________________。
(3)探究硫脲的性质:①取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是_____(填化学式,下同)
②向盛有少量硫脲的试管中加入NaOH溶液,有NH3放出,检验该气体的方法为 ______。
③可用酸性KMnO4溶液滴定硫脲,已知MnO![]() 被还原为Mn2+,CS(NH2)2被反应为CO2、N2及SO
被还原为Mn2+,CS(NH2)2被反应为CO2、N2及SO![]() ,该反应中氧化剂与还原剂的物质的量之比为_____。
,该反应中氧化剂与还原剂的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol L-1HB溶液中逐滴滴入 0.1mol L-1NaOH溶液,所得 PH变化曲线如图所示。下列说法错误的是
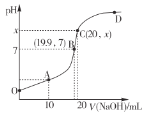
A.OA各点溶液均存在:c(B-) >c(Na+)
B.C至 D各点溶液导电能力依次增强
C.点 O时,pH>1
D.点 C时,X约为 10.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验说法,正确的是
A.某溶液加强碱并加热,产生使湿润的红色石蕊试纸变蓝的气体,则该溶液溶质为铵盐
B.将硝酸亚铁样品溶于稀硫酸,滴加硫氰化钾溶液,溶液变为血红色,可推知该样品已经氧化变质
C.往含有FeBr2和FeI2的混合溶液中通入足量的氯气,然后把溶液蒸干,得到FeCl3固体
D.向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅,证明Na2CO3溶液中存在水解平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com