
���� ��1��H2O2+2KI+H2SO4=I2+K2SO4+2H2O��O��-1�۽��͵�-2�ۣ�I��-1�����ߵ�0�ۣ�ת�Ƶ�����Ϊ2��
��2����Ӧ�����У�I2���뷴Ӧ�����������ɵ�����I2���ӿ��������ķֽ⣬I2��������ã�
��3�����������ԣ������������������жϣ�
��� �⣺��1��H2O2+2KI+H2SO4=I2+K2SO4+2H2O��O��-1�۽��͵�-2�ۣ�I��-1�����ߵ�0�ۣ�ת�Ƶ�����Ϊ2������˫���ŷ���ʾ����ת��Ϊ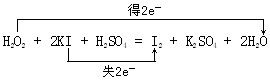 ��
��
�ʴ�Ϊ��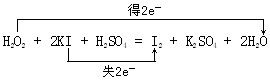 ��
��
��2����Ӧ�����У�I2���뷴Ӧ�����������ɵ�����I2���ӿ��������ķֽ⣬I2��������ã�
�ʴ�Ϊ��������
��3���ɢ�H2O2+I2��2HIO����֪�����ԣ�H2O2��HIO���ɢ�H2O2+2HIO��I2+O2��+2H2O����֪�����ԣ�HIO��O2���������ԣ�H2O2��HIO��O2��
�ʴ�Ϊ��H2O2��HIO��O2��
���� �����ۺϿ���������ԭ��Ӧ�������ڿ���ѧ�������ݷ����������ۺ����û�ѧ֪ʶ����������Ŀ�Ѷ��еȣ�ע�����������ǿ���ıȽϷ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | v��A��=0.9 mol/��L•s�� | B�� | v��B��=0.5 mol/��L•s�� | C�� | v��C��=1.4 mol/��L•s�� | D�� | v��D��=1.8 mol/��L•s�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
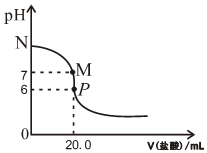 298Kʱ����20.0mL0.20mol•L-1��ˮ�е���0.20mol•L-1�����ᣬ��Һ��pH����������������ϵ��ͼ��ʾ��
298Kʱ����20.0mL0.20mol•L-1��ˮ�е���0.20mol•L-1�����ᣬ��Һ��pH����������������ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A | B | C | D |
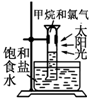 | 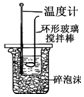 | 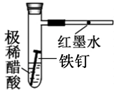 | 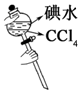 |
| CH4��ȡ����Ӧ | �к��ȵIJⶨ | ��֤���ĵ绯ѧ��ʴ���� | ����CCl4��ȡI2 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�a L�������͵����Ļ���ﺬ�еķ�����ԼΪ$\frac{a}{22.4}$��6.02��1023 | |
| B�� | ��1L 1 mol•L-1�� FeCl3��Һ�ƳɵĽ����н�������С��NA�� | |
| C�� | 2.3g�����Ʊ�Ϊ������ʧȥ0.1NA���� | |
| D�� | 2.24L CO2�к��е�ԭ����Ϊ3��0.1��6.02��1023 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��ͭ������ۻ�Ͼ��ȼ�������ȡCuS | |
| B�� | ��ͭ˿����Ũ�����в����ȣ���Ӧ���ټ�ˮ�Թ۲�CuSO4��Һ����ɫ | |
| C�� | ��CuSO4��Һ�м��������NaOH��Һ������ϴ�Ӳ��ռ����������������ȡCuO | |
| D�� | �������Һ�м�������ϡ�����ȣ��ټ���������Cu��OH��2�����ȣ�����ש��ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | NaOH�������ʱ����� | B�� | ʢ�ű�����ĵζ����ü�Һ��ϴ | ||
| C�� | �÷�̪��ָʾ�� | D�� | ����NaOH�к���Na2O���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com