
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H_____0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如下图所示。在0-60s时段,反应速率v(N2O4)为_____molL-1s-1反应的平衡常数K1为_______。
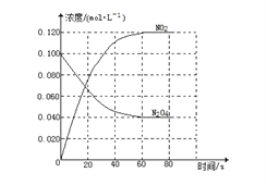
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10s又达到平衡。
①T_____100℃(填“大于”“小于”),判断理由是___________________________。
②列式计算温度T时反应的平衡常数K2_______________。
【答案】 大于 0.0010 0.36 大于 反应正方向吸热,反应向吸热方向进行,故温度升高 K2= (0.16 mol·L-1)2/(0.020 mol·L-1) =1.3 mol·L-1
【解析】(1)随温度升高,混合气体颜色加深,说明升高温度平衡正向移动,则正反应为吸热反应,即△H>0;0~60s时段,N2O4浓度变化为:0.1mol·L-1-0.04mol·L-1=0.06mol·L-1,v(N2O4)=0.06mol·L-1/ 60s =0.0010 molL-1s-1;反应的平衡常数K1为![]() ;(2))①改变温度后,N2O4的浓度降低,平衡向正反应方向移动,由于正反应吸热反应,升高温度平衡正向移动,故T>100℃;判断理由是反应正方向吸热,反应向吸热方向进行,故温度升高;②平衡时,c(NO2)=0.120mol·L-1+0.0020mol·L-1s-1×10s×2=0.16mol·L-1,c(N2O4)=0.040mol·L-1-0.0020mol·L-1·s-1×10s=0.020mol·L-1,故K2=(0.16 mol·L-1)2/(0.020 mol·L-1) =1.3 mol·L-1
;(2))①改变温度后,N2O4的浓度降低,平衡向正反应方向移动,由于正反应吸热反应,升高温度平衡正向移动,故T>100℃;判断理由是反应正方向吸热,反应向吸热方向进行,故温度升高;②平衡时,c(NO2)=0.120mol·L-1+0.0020mol·L-1s-1×10s×2=0.16mol·L-1,c(N2O4)=0.040mol·L-1-0.0020mol·L-1·s-1×10s=0.020mol·L-1,故K2=(0.16 mol·L-1)2/(0.020 mol·L-1) =1.3 mol·L-1


科目:高中化学 来源: 题型:
【题目】已知无水AlCl3遇潮湿空气即产生大量白雾,实验室可用如图所示装置制备AlCl3.
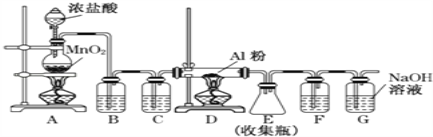
(1)装置A中发生反应的化学方程式为________________________________________.
(2)装置B盛放的试剂是______,其作用是_______________________________;装置C盛放的试剂是______,其作用是____________________________________.
(3)装置G的作用是________________,G中发生反应的化学方程式是_______.
(4)F中盛放的试剂是______,其作用是___________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一块表面被氧化的铝分成两等分,若向其中一份中滴加1molL-1的NaOH溶液,向另一份中滴加x molL-1的稀盐酸,产生氢气的物质的量与所加NaOH溶液、稀盐酸的体积关系如图所示.下列说法不正确的是( )
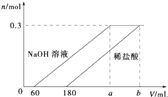
A. a=260
B. x=1mol/L
C. 该铝块的总质量为8.46g
D. 该铝块中氧化铝与铝单质的物质的量之比为3:20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。
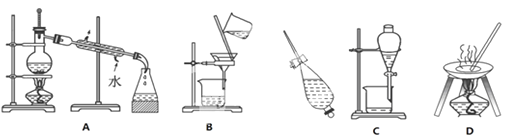
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D 填入适当的空格中。
①除去粗盐中的泥沙_________________;
②与海水晒盐原理相似的是___________;
③用四氯化碳碘水中提取碘___________;
④分离CCl4(沸点:76.75℃)和苯(沸点:110.6℃)的混合物(互溶)______;
(2)下列关于物质的检验说法不正确的是________________。
A.待检液加入BaCl2溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,则原溶液中一定有SO42- 存在
B.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤后灼烧至无色,然后再用铂丝蘸取固体氯化钾,置于火焰上进行灼烧,透过蓝色钴玻璃进行观察
C.待检液加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定有NH4+ 存在
D.待检液加入盐酸,产生无色无味的气体,则原溶液中一定有CO32- 存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A. 28 g氮气含有的原子数为NA
B. 标准状况下,22.4 L 水中含有的水分子数为NA
C. 1 molOHˉ含有的电子数为10NA
D. 0.1 L 1 mol /L NaCl溶液中含有Na+个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。下列关于该电池叙述错误的是( )
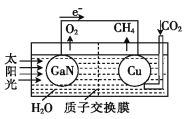
A.电池工作时,是将太阳能转化为电能
B.铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
D.为提高该人工光合系统的工作效率,可向装置中加入少量盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480mL含NaClO25%,密度为1.19g/cm3的消毒液.下列说法正确的是( )
A. 配制过程只需要三种仪器即可完成
B. 容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C. 定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低
D. 需用托盘天平称量的NaClO固体的质量为148.8g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com