
【题目】常温下,在10 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示,下列说法不正确的是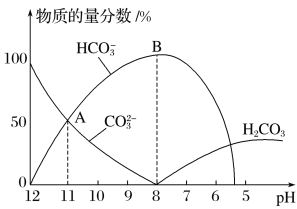
A.溶液的pH为7时,溶液的总体积大于20 mL
B.在B点所示的溶液中:c(Na+)+c(H+) =2c(![]() )+c(
)+c(![]() )+c(OH-)+c(Cl-)
)+c(OH-)+c(Cl-)
C.在A点所示的溶液中: c(Na+)=c(![]() )=c(
)=c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.已知CO32-水解常数为2×10-4,当溶液中c(HCO3-)=2c(![]() )时,溶液的pH=10
)时,溶液的pH=10
【答案】C
【解析】
A.当混合溶液体积为20mL时,二者恰好反应生成NaHCO3,HCO3-的电离程度小于其水解程度,所以其溶液呈碱性,要使混合溶液呈中性,则酸稍微过量,所以混合溶液体积稍微大于20mL,故不选A;
B.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+) =2c(![]() )+c(
)+c(![]() )+c(OH-)+c(Cl-),故不选B;
)+c(OH-)+c(Cl-),故不选B;
C.根据图象分析,A点为碳酸钠,碳酸氢钠、氯化钠的混合溶液,且c(HCO3-)=c(CO32-),溶液呈碱性,则c(OH-)>c( H+),盐溶液水解程度较小,所以c(CO32-)>c(OH-),则离子浓度大小顺序是c(Na+)>c(HCO3-)=c(CO32-)>c(OH-)>c( H+),故选C;
D.根据Kh=![]() 计算可得c(OH-)=10-4,因此溶液的pH=10,故不选D;
计算可得c(OH-)=10-4,因此溶液的pH=10,故不选D;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列说法正确的是
A.12g![]() 的原子核内中子数为6NA
的原子核内中子数为6NA
B.9.0g葡萄糖和蔗糖的混合物中含碳原子的数目为0.3NA
C.25℃时,1LpH=2的H2C2O4溶液中含H+的数目为0.02NA
D.标准状况下,2.24LCO2与足量Na2O2反应转移的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的镁分别在足量的二氧化碳、氧气中燃烧,有关叙述正确的是( )
A.在二氧化碳中燃烧产生的固体质量大
B.在氧气中产生的氧化镁质量大
C.氧化剂与还原剂物质的量之比都是2∶1
D.反应中都是氧元素被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I具有贝类足丝蛋白的功能,可广泛用于表面化学、生物医学、海洋工程、日化用品等领域。其合成路线如图:
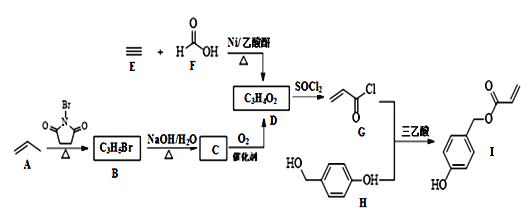
回答下列问题:
(1)I中含氧官能团的名称为____。
(2)由B生成C的化学方程式为__。
(3)由E和F反应生成D的反应类型为____,由G和H反应生成I的反应类型为____。
(4)仅以D为单体合成高分子化合物的化学方程式为___。
(5)X是I的芳香同分异构体,能发生银镜反应,能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1。写出两种符合要求的X的结构简式___。
(6)参照本题信息,试写出以1丁烯为原料制取 的合成路线流程图(无机原料任选)___。
的合成路线流程图(无机原料任选)___。
合成路线流程图示例如图:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式___。
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ/mol
(2)己知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l)![]() C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___。
a.增大CO2的浓度 b.取走一半C6H12O6 c.加入催化剂 d.适当升高温度
(3)N2O5的分解反应2N2O5(g)![]() 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2)=___molL-1min-1。
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。
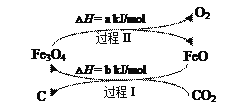
①在转化过程中起催化作用的物质是___;
②写出总反应的化学方程式___。
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l)
根据上述反应,填写下列空白
①己知该反应可以自发进行,则△
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比![]() =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。
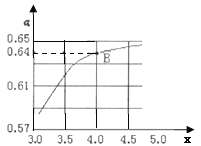
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的![]() 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在金刚石、CS2、N2、C2H4、H2O2、金属Fe 等六种晶体中:
(1)以非极性键结合的非极性分子是______________;
(2)通过非极性键形成的原子晶体是______________;
(3)含有极性共价键和非极性共价键的非极性分子是______________;
(4)固态和熔融状态下都能导电的晶体是______________;
Ⅱ、C和Si元素在化学中占有极其重要的地位.
(1)CO2属于______________晶体,熔化时克服的微粒间作用力是______________;SiO2属于______________晶体,熔化时克服的微粒间作用力是______________;所以熔点CO2 ______________SiO2(填“<”、“=”或“>”).
(2)SiO2晶体中每个硅与______________个O相连,每个氧与______________Si相连.
(3)石墨晶体中,层内形成正六边形的平面网状结构,试分析层内每个正六边形占有的碳原子数为___________个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是典型的半导体材料,在光照射下导电性可提高近千倍。图1是从某工厂的硒化银半导体废料(含Ag2Se、Cu单质)中提取硒、银的工艺流程图:
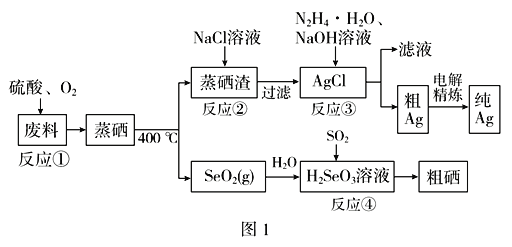
(1)为提高反应①的浸出速率,可采取的措施为______________(答出两条)。
(2)已知反应③生成一种可参与大气循环的气体单质,写出该反应的离子方程式__________。
(3)反应②为Ag2SO4(s)+2Cl-(aq)![]() 2AgCl(s)+
2AgCl(s)+![]() (aq);常温下,Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图2所示。则Ag2SO4(s)+2Cl-(aq)
(aq);常温下,Ag2SO4、AgCl的饱和溶液中阳离子和阴离子浓度关系如图2所示。则Ag2SO4(s)+2Cl-(aq) ![]() 2AgCl(s)+
2AgCl(s)+![]() (aq)的化学平衡常数的数量级为________。
(aq)的化学平衡常数的数量级为________。
(4)写出反应④的化学方程式________________________________________。
(5)室温下,H2SeO3水溶液中H2SeO3、![]() 、
、![]() 的物质的量分数随pH的变化如图3所示,则室温下H2SeO3的Ka2=________。
的物质的量分数随pH的变化如图3所示,则室温下H2SeO3的Ka2=________。
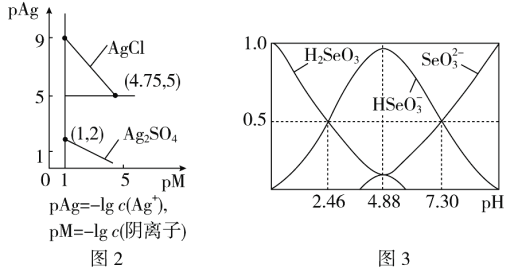
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝( AlN)是一种新型无机非金属材料,常温下AlN +NaOH+H2O=NaAlO2+NH3↑。某课题小组利用甲图所示装置测定样品中AlN的含量(杂质不反应)。下列说法中正确的是
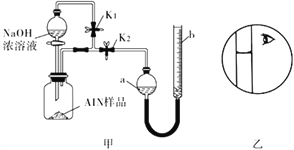
A. 量气管中的液体应为水
B. 用长颈漏斗代替分液漏斗,有利于控制反应速率
C. 反应结束时,a、b两管液面的差值即为产生气体的体积
D. 若其它操作均正确,实验结束时按乙图读数,测得AlN含量偏高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是原子序数依次增大的短周期主族元素。已知:气体YX3能使润湿的紫色石蕊试纸变蓝,Z和X在同一主族,Q原子的最外层电子数是其周期序数的2倍。回答下列问题:
(1)![]() 原子的结构示意图为 _____,YX3的化学式为 _____。
原子的结构示意图为 _____,YX3的化学式为 _____。
(2)![]() 、Q、R原子的半径从大到小的顺序是 ___________。
、Q、R原子的半径从大到小的顺序是 ___________。![]() 用原子符号表示
用原子符号表示![]() 。
。
(3)![]() 分别与X、Z形成的化合物分别是__________(填化学式),___________(填电子式)。Q与Z形成的化合物类型是_________(填离子化合物或共价化合物)。
分别与X、Z形成的化合物分别是__________(填化学式),___________(填电子式)。Q与Z形成的化合物类型是_________(填离子化合物或共价化合物)。
(4)能证明R的非金属性比Q强的实验事实是______![]() 填字母序号
填字母序号![]() 。
。
A HR的水溶液酸性比H2Q的水溶液酸性强 B R2与H2化合比Q与H2化合容易。
C R的最高价氧化物的水化物的酸性比Q的强 D HR的稳定性比H2Q强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com