
右图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀或气体的物质的量。下列反应对应的曲线错误的是( )

A.向NaAlO2溶液中滴入HCl至过量
B.向澄清石灰水中通入CO2至过量
C.向Na2CO3溶液中滴入盐酸至过量
D.向含有等物质的量的KOH、Ba(OH)2的混合溶液中通入CO2至沉淀消失
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届山东省济宁市高三上学期期中考试化学试卷(解析版) 题型:选择题
设NA代表阿伏伽德罗常数的数值,下列说法正确的是( )
A.1mol硫酸铝钾中阴离子所带电荷数为2NA
B.标准状况下,NA个SO3分子所占的体积约为22.4L
C.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NAFe3+
D.标准状况下,22.4L Cl2与足量氢氧化钠溶液反应转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期10月阶段测化学试卷(解析版) 题型:实验题
二氧化氯(ClO2黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制各ClO2:


己知:NCl3中Cl元素化合价为+1价,具有强氧化性
①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有 。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
A、水 B、碱石灰 C、浓硫酸 D、饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
I、在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
II、在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
III、.将一定量的混合气体通入锥形瓶中吸收;
IV、将玻璃液封装置中的水倒入锥形瓶中;
V、用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I- +S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为 。
②玻璃液封装置的作用是 。
③V中加入的指示剂通常为 ,滴定至终点的现象是 。
④测得混合气体中ClO2的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁师范大学附属中学高三上学期期中考试化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A. 标准状况下2.24L氯气与水充分反应转移电子数为0.1NA
B. 标况下,2.24LNO2分子总数小于0.1NA
C. 标准状况下2.24L的CCl4中含有的C—Cl键数为0.4NA
D. 6.8g液态KHSO4中含有0.1NA个阳离子
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第三次考试化学试卷(解析版) 题型:填空题
H、C、N、O、Fe、Si、I是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)根据元素周期律,碳的非金属性强于硅,请用一个化学反应方程式表示___________________。
(2)若FeSO4和O2的系数比为2:1,试配平下列方程式:__FeSO4+__K2O2→__K2FeO4+__K2O+__K2SO4+__O2↑
(3)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOX)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:NO2+NO+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
现有一NO与NO2的混合气体,将其通入50mL 2mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3― 0.02mol。
①所得溶液中NaNO2的物质的量为 mol;
②混合气体中V(NO):V(NO2)= 。
(4)向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)的变化可用下图简单表示
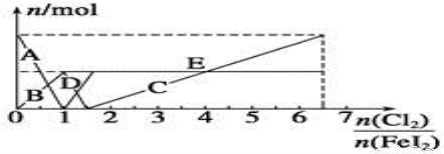
①当n(Cl2)∶n(FeI2)=6.5时,溶液中n(Cl-)∶n(IO3-)= 。
②当n(Cl2)∶n(FeI2)=1.2时,离子方程式可表示为 。
查看答案和解析>>
科目:高中化学 来源:2016届江西上高第二中学高三12月月考理科综合化学试卷(解析版) 题型:选择题
3.04g铜镁合金完全溶解于含1.4molHNO3的浓HNO3中,得到NO2和N2O4混合气2240mL(标准状况下).向反应后的溶液中加入2mol•L﹣1NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀,下列说法不正确的是( )
①该合金中镁与铜的物质的量之比为1:2
②NO2和N2O4的混合气体中,N2O4的体积分数为80%
③得到5.08g沉淀时,加入NaOH溶液的体积是620mL
④该反应中共转移电子为1.2NA.
A.③ B.②③④ C.①③ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三第四次(12月)月考化学试卷(解析版) 题型:选择题
下列有关化学用语表述正确的是
A.S2-的结构示意图:
B.Na2S的电子式:
C.邻羟基苯甲酸的结构简式:
D.质子数与中子数相等的硫原子: S
S
查看答案和解析>>
科目:高中化学 来源:2016届广西柳州铁路第一中学高三上学期10月月考理化学试卷(解析版) 题型:选择题
已知X、Y、Z、W、R是原子序数依次增大的五种短周期主族元素,其中Y、R原子最外层电子数相等;X元素最低负价与W元素最高正价绝对值相等;工业上常用电解熔融氧化物的方法冶炼W单质;Z、W、R最高价氧化物对应的水化物两两反应均生成盐和水。下列说法正确的是( )
A. 简单离子半径:Y>Z>W
B. 简单氢化物的热稳定性:X>Y>R
C. W的最高价氧化物对应的水化物碱性比Z的强
D. R的最高价氧化物对应的水化物化学式一定是HRO4
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高二上期中考试化学试卷卷(解析版) 题型:填空题
有甲乙两个容积均为1L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g) xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:
xC(g),①向甲中通入4molA、2molB,达平衡时测得其中C的体积分数为40%;②向乙中通入1molA、0.5molB和3molC,平衡时测得C的体积分数为W%。试回答:
(1)甲平衡时A的体积分数为 ;
(2)若乙W%=40%,且建立平衡的过程中乙压强有变化 ,则x= ,乙中 建立平衡时压强的变化为 (填“递增”或“递减”);
建立平衡时压强的变化为 (填“递增”或“递减”);
(3)若乙W%=40%,且平衡时甲、乙压强不同,则x= ,平衡时甲的压强 乙的压强(填“大于”或“小于”),乙平衡时c(A)= ;
(4)若x=4,则W% 40%(填“大于”、“小于”或“等于”,下同);平衡时乙中的c(A) 甲中的c(A)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com