
【题目】E是合成某药物的中间体,其一种合成路线如图:

(1)A中含氧官能团的名称是___。
(2)A→B的反应条件和试剂是___。
(3)D→E的反应类型是___。
(4)写出B→C的化学方程式___。
(5)E的分子式为___。
(6)B的环上二溴代物有___种(不考虑立体异构)。
科目:高中化学 来源: 题型:
【题目】如图所示为从固体混合物中分离X的两种方案,请根据方案1和方案2指出下列说法中合理的是

A.方案2中加入HCl溶液可以分离出BaSO4和Fe2O3混合物中的BaSO4
B.方案2中加入的试剂一定能够与除X外的物质发生化学反应
C.方案1中的残留物应该具有的性质是受热易挥发
D.可以选用方案1分离碳酸钠中含有的氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下部分弱电解质的电离平衡常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | 6.8×104 | 4.7×108 | K1=4.3×107 K2=5.6×1011 | Kb=1.7×105 |
(1)常温下,物质的量溶度相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其PH由大到小的顺序是___________(填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)NaClO溶液中的电荷守恒关系为_________________
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________(填“酸性”“碱性”“中性”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCO3是一种制造锂电池电极的原料。以含钴废渣(主要成分CoO、Co2O3,还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)

(1)“酸浸”时通入SO2的目的是__。
(2)“除铝”时调节溶液pH范围为__,该过程中主要反应的离子方程式为__。
(3)“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)![]() ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是__。
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是__。
(4)“沉钴”时Na2CO3溶液需缓慢滴加的原因是 __。
(5)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种清洁能源和重要化工原料。
(1)下列事实能说明CH4分子呈正四面体结构的是___(填字母)。
A.CH4分子的4个C—H共价键键长相等
B.CH4分子中每个键角都是109°28′
C.CH2F2没有同分异构体
D.CCl4的沸点高于CH4的
(2)甲烷与下列烃的通式相同的是___(填字母)。

(3)已知断裂几种化学键要吸收的能量如下:
化学键 | C—H | O=O | C=O | H—O |
断裂1mol键吸收的能量/kJ | 415 | 497 | 745 | 463 |
16gCH4在O2中完全燃烧生成气态CO2和气态水时___(填吸收”或放出”)约___ kJ热量。
(4)天然气/空气燃料电池中,若KOH为电解质,负极反应式为___。等质量的甲烷分别以稀硫酸、KOH溶液为电解质溶液完全放电时,理论上提供的电能之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院大连化学物理研究所的“甲醇制取低碳烯经(![]() 技术”获得国家科学技术发明一等奖,该技术先由煤气化制合成气再由合成气制甲醇和氨气,最后由甲醇制乙烯和丙烯。
技术”获得国家科学技术发明一等奖,该技术先由煤气化制合成气再由合成气制甲醇和氨气,最后由甲醇制乙烯和丙烯。
(1)煤气化包含一系列化学反应,已知热化学方程式:
![]()
![]()
![]()
![]()
则反应![]()
![]() _____
_____![]()
(2)以投料比![]() 合成甲醇:
合成甲醇:![]() ,温度、压强与
,温度、压强与![]() 的平衡转化率的关系如图所示
的平衡转化率的关系如图所示

回答下列问题:
①![]() _____(填>”或“<)0
_____(填>”或“<)0
②![]() ______(填“>“或“<”)
______(填“>“或“<”)![]()
③![]() ,
,![]() 时,
时,![]() 点的
点的![]() _____(填>”或"<")
_____(填>”或"<")![]() 。
。
④若起始时提高投料比![]() 的平衡转化率将_______(填”増大”或“减小”)。
的平衡转化率将_______(填”増大”或“减小”)。
⑤参照下表,实际工业生产中大多采用![]() 和
和![]() ,其优点是____________。
,其优点是____________。
span>方法 | 催化剂 | 条件 | 备注 | 特点 | |
压力 | 温度 | ||||
高压法 |
二元催化剂 | 25~30 | 380~400 | 1924年工业化 | (1)催化剂不易中毒,再生困难 (2)副反应多 |
低压法 |
三元催化剂 | 5 | 230~270 | 1966年工业化 | (1)催化剂易中毒,再生容易,寿命为1~2年 (2)副反应少 |
(3)![]() 和
和![]() 生成
生成![]() 的反应为
的反应为![]()
![]() ,在
,在![]() 催化剂作用下的反应历程如下(
催化剂作用下的反应历程如下(![]() 表示吸附态)
表示吸附态)
化学吸附:![]() ;
;![]()
表面反应![]() ;
;![]() ,
,![]()
脱附:![]()
其中,![]() 的吸附分解反应活化能高,速率慢,决定了合成氨的整体反应速率.
的吸附分解反应活化能高,速率慢,决定了合成氨的整体反应速率.
①有利于提高合成氨平衡产率的条件有______(填字母)
A 低温 B 高温 C 低压 D 高压 E 催化剂
②标准平衡常数![]() =
=![]() ,其中
,其中![]() 为标准压强(
为标准压强(![]() ),
),![]() 、
、![]() 和
和![]() 为各组分的平衡分压,如
为各组分的平衡分压,如![]() ,
,![]() 为平衡总压,
为平衡总压,![]() 为平衡系统中
为平衡系统中![]() 的物质的量分数.已知起始时向一密闭容器中投入
的物质的量分数.已知起始时向一密闭容器中投入![]()
![]() 和
和![]()
![]() ,反应
,反应![]()
![]() +
+![]()
![]()
![]()
![]() 在恒定温度和标准压强下进行,
在恒定温度和标准压强下进行,![]() 的平衡产率为
的平衡产率为![]() ,则该反应的
,则该反应的![]() =________(用含
=________(用含![]() 的代数式表示)。下图中可以表示标准平衡常数随温度
的代数式表示)。下图中可以表示标准平衡常数随温度![]() 的变化趋势的是____________(填字母)
的变化趋势的是____________(填字母)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)顺铂(化学名称为顺二氯二氨合铂(II),化学式为PtCl2(NH3)2,相对分子质量为:300)是一种用于治疗癌症的药物,一片顺铂药片所含顺铂的质量为6×10-4g,那么一片顺铂药片中N原子的物质的量___mol;
(2)乙烯气体(C2H4)是石油化工产品之一,也是最重要的有机化工基础原料之一,在标准状况下其密度为___gL-1;
(3)现有一种矿泉水样品,1.0L的该矿泉水含有4.8×10-2gMg2+,则___L矿泉水中含有1mol Mg2+;
(4)某“84消毒液”1000mL,其有效成分为NaClO(式量:74.5),质量分数为14.9%,密度为1.2g/mL,其溶质的物质的量浓度为___molL﹣1;
(5)已知CO和CO2的混合气体7.2g,在标准状况下所占的体积为4.48L。则该混合气体中氧元素的质量为___g;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现将200mL0.30mol/L的盐酸与50mL0.80mol/LCaCl2溶液混合(混合后体积变化忽略不计),所得溶液中Cl-的物质的量浓度是___。
(2)将20.0g氢氧化钠固体溶于水配成100mL溶液,其密度为1.25g·mL-1。该溶液中氢氧化钠的物质的量浓度为___,质量分数为___,从该溶液中取出10 mL,将其加水稀释到100 mL,稀释后溶液中氢氧化钠的物质的量浓度为___,将一定体积的原溶液和稀释后的溶液按1:4的体积比混合(忽略混合时溶液体积变化),所得混合溶液中氢氧化钠的物质的量浓度为___。
(3)气体化合物A分子式可表示为OxFy,已知同温同压下10mLA受热分解生成15mLO2和10mLF2,则A的化学式为___,推断的依据为___;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
镍及其化合物是重要的合金材料和催化剂。请回答下列问题:
(1)基态镍原子的价电子排布式为_____,排布时能量最高的电子所占能级的原子轨道有____个伸展方向。
(2)镍能形成多种配合物如正四面体形的Ni(CO)4 和正方形的[Ni(CN)4]2-、正八面体形的[Ni(NH3)6]2+等。下列说法正确的有___
A.CO与CN-互为等电子体,其中CO分子内σ键和π键个数之比为1:2-
B.NH3的空间构型为平面三角形
C.Ni2+在形成配合物时,其配位数只能为4
D.Ni(CO)4和[Ni(CN)4]2-中,镍元素均是sp3杂化
(3)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图所示。该结构中,除共价键外还存在配位键和氢键,请在图中用“→”和“”分别表示出配位键和氢键。_____
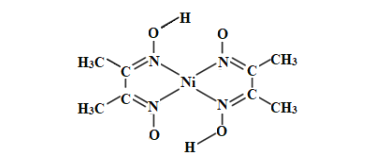
(4)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
![]()
NiO晶胞中Ni2+的配位数为____,NiO熔点比NaCl高的原因是_____。
(5)研究发现镧镍合金LaNix是一种良好的储氢材料。属六方晶系,其晶胞如图a中实线所示,储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
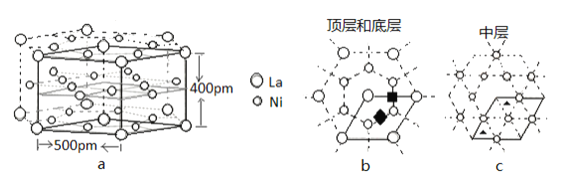
①LaNix合金中x的值为_____;
②晶胞中和“![]() ”同类的八面体空隙有___个,和“
”同类的八面体空隙有___个,和“![]() ”同类的四面体空隙有___个。
”同类的四面体空隙有___个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______g/cm-3(保留2位有效数字,NA=6.0×1023,![]() =1.7)
=1.7)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com