
【题目】在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0。
2NH3(g) △H<0。
(1)反应开始阶段,V(正)_______(填“>”“<”或“=”)v(逆),随后v(正)逐渐______(填“增大”或“减小”,下同),v(逆)逐渐_________,反应达到平衡时,v(正)等于v(逆)。
(2)达到平衡后,若正反应速率用v(N2)表示,逆反应速率用v'(H2)表示,则v(N2)=_____v'(H2)。
(3)下列措施中能加快反应速率并提高氢气的转化率的是_____________(填字母)。
A.其他条件不变时,压缩容器体积 B.其他条件不变时,升高反应体系温度
C.使用合适的催化剂 D.保持容器体积不变,充入一定量的氮气
(4)实际生产中往往需要将温度控制在一个合适的范围,分析温度不宜过高也不宜过低的原因:_________________________________________________________。
(5)写出合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的平衡常数表达式:____________________。升高温度时K值_________(填“增大”“减小”或“不变”)。
2NH3(g)的平衡常数表达式:____________________。升高温度时K值_________(填“增大”“减小”或“不变”)。
【答案】> 减小 增大 ![]() AD 该反应是放热反应,温度过高,反应物的转化率下降,温度过低,反应速率过慢;且催化剂在一定温度范围内活性最强
AD 该反应是放热反应,温度过高,反应物的转化率下降,温度过低,反应速率过慢;且催化剂在一定温度范围内活性最强 ![]() 减小
减小
【解析】
(1)反应开始阶段,正反应速率大于逆反应速率,随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大,达到平衡时,正逆反应速率相等。
(2)达到平衡时正逆反应速率相等,且满足反应速率之比等于化学计量数之比。
(3)一般来说,升高温度、增大浓度、缩小体积以及加入催化剂等,可加快反应速率;对于物质的量减小的反应,缩小体积、增大其他反应物浓度可以提高转化率。
(4)实际生产中由于该反应是放热反应,温度过高,反应物的转化率下降,温度过低,反应速率过慢;且催化剂在一定温度范围内活性最强,所以温度不宜过高也不宜过低。
(5)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值。
(1)反应开始阶段,正反应速率大于逆反应速率,随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大,达到平衡时,正逆反应速率相等,故答案为:>,减小,增大;
(2)达到平衡时正逆反应速率相等,且满足反应速率之比等于化学计量数之比,则v(N2)=![]() v'(H2),故答案为:
v'(H2),故答案为:![]() ;
;
(3)一般来说,升高温度、增大浓度、缩小体积以及加入催化剂等,可加快反应速率;对于物质的量减小的反应,缩小体积、增大其他反应物浓度可以提高转化率。B.升高温度平衡逆向移动,不能提高氢气转化率,C.使用催化剂同样不能提高氢气转化率,故答案为:AD;
(4)实际生产中由于该反应是放热反应,温度过高,反应物的转化率下降,温度过低,反应速率过慢;且催化剂在一定温度范围内活性最强,所以温度不宜过高也不宜过低。故答案为:该反应是放热反应,温度过高,反应物的转化率下降,温度过低,反应速率过慢;且催化剂在一定温度范围内活性最强。
(5)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值,![]() ,升高温度,反应逆向进行,K会减小,故答案为:
,升高温度,反应逆向进行,K会减小,故答案为:![]() ,减小。
,减小。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】菱铁矿![]() 主要成分是
主要成分是![]() 是炼铁的原料.已知
是炼铁的原料.已知![]() 为白色固体,不溶于水,在干燥空气中稳定,潮湿环境中需较长时间被氧化为
为白色固体,不溶于水,在干燥空气中稳定,潮湿环境中需较长时间被氧化为![]() .
.
I.![]() 甲同学取一定量碳酸亚铁固体于烧杯中,加入足量水,将烧杯放置在天平左盘上,向右盘放入砝码至天平平衡.放置较长时间后
甲同学取一定量碳酸亚铁固体于烧杯中,加入足量水,将烧杯放置在天平左盘上,向右盘放入砝码至天平平衡.放置较长时间后![]() 不考虑水分蒸发
不考虑水分蒸发![]() ,观察到天平的指针会______
,观察到天平的指针会______![]() 填“偏左”、“偏右”、“不发生偏转”
填“偏左”、“偏右”、“不发生偏转”![]() ;放置过程中还可观察到的实验现象为______.
;放置过程中还可观察到的实验现象为______.
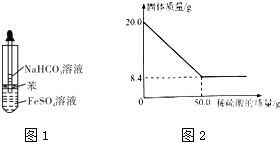
![]() 乙同学设计图1所示的装置制备
乙同学设计图1所示的装置制备![]() 和
和![]() 溶液均用经煮沸后冷却的蒸馏水配制,并在
溶液均用经煮沸后冷却的蒸馏水配制,并在![]() 溶液中加入少量铁粉
溶液中加入少量铁粉![]() 滴加
滴加![]() 溶液后观察到试管中出现白色沉淀,同时有大量无色气体生成.
溶液后观察到试管中出现白色沉淀,同时有大量无色气体生成.
![]() 产生的气体是______
产生的气体是______![]() 填分子式
填分子式![]() .
.
![]() 丙同学对白色沉淀的成分提出异议,并做出如下假设,请补充完成假设3:
丙同学对白色沉淀的成分提出异议,并做出如下假设,请补充完成假设3:
假设1:白色沉淀是![]() ;
;
假设2:白色沉淀是![]() ;
;
假设3:白色沉淀是______.
![]() 若假设1成立,写出有关反应的化学方程式:______.
若假设1成立,写出有关反应的化学方程式:______.
![]() 若假设2成立,说明用经煮沸后冷却的蒸馏水配制
若假设2成立,说明用经煮沸后冷却的蒸馏水配制![]() 和
和![]() 溶液的目的是______.请设计一个实验方案验证假设2成立,写出实验步骤、预期现象和结论,实验所需仪器和药品自选. ______.
溶液的目的是______.请设计一个实验方案验证假设2成立,写出实验步骤、预期现象和结论,实验所需仪器和药品自选. ______.
![]() 现取
现取![]() 菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图2所示.
菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图2所示.![]() 假设菱铁矿中杂质不参加反应,且难溶于水.
假设菱铁矿中杂质不参加反应,且难溶于水.![]()
![]() 菱铁矿中
菱铁矿中![]() 的质量分数为______
的质量分数为______
![]() 若将稀硫酸改成1mol
若将稀硫酸改成1mol![]() ,则该反应的离子方程式为______
,则该反应的离子方程式为______![]() 将反应逸出的气体与一定量的
将反应逸出的气体与一定量的![]() 混合循环通入反应液中,目的是______.
混合循环通入反应液中,目的是______.
![]() 某铁锈成分为
某铁锈成分为![]() 和
和![]() 为确定其组成,兴趣小组称取此铁锈样品
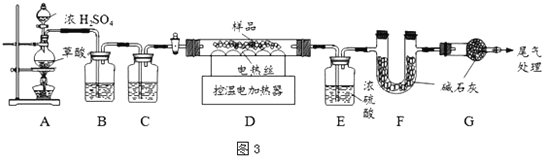
为确定其组成,兴趣小组称取此铁锈样品![]() ,在科研人员的指导下用图3装置进行实验.
,在科研人员的指导下用图3装置进行实验.
(查阅资料)
①![]() 失去结晶水温度为
失去结晶水温度为![]() ,
,![]() 在
在![]() 分解为FeO和
分解为FeO和![]() .
.
②温度高于![]() 时铁的氧化物才能被CO还原.
时铁的氧化物才能被CO还原.
![]() 装配好实验装置后,首先要______.
装配好实验装置后,首先要______.
![]() 装置A中的反应为:
装置A中的反应为: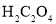
![]() 草酸)
草酸) 
![]() 通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放______
通过B、C装置可得到干燥、纯净的CO气体,洗气瓶B中应盛放______![]() 选填序号
选填序号![]() .
.
![]() 浓硫酸
浓硫酸![]() 澄清的石灰水
澄清的石灰水![]() 氢氧化钠溶液
氢氧化钠溶液
![]() 现控制D装置中的温度为
现控制D装置中的温度为![]() 对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重
对铁锈进行热分解,直至D装置中剩余固体质量不再变化为止,冷却后装置E增重![]() ,装置F增重
,装置F增重![]() .则样品中
.则样品中![]() 的质量
的质量![]() ______g,
______g,![]() ______.
______.
![]() 若缺少G装置,测得的
若缺少G装置,测得的![]() ______
______![]() 选填“偏大”、“偏小”、“不变”,下同
选填“偏大”、“偏小”、“不变”,下同![]() ,x的值会______.
,x的值会______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,CuSO4·5H2O(s)、CuSO4(s)与其水溶液之间转化的焓变关系如图:

己知CuSO4·5H2O(s)溶于水,溶液温度降低;CuSO4(s)溶于水,溶液温度升高。
下列有关说法不正确的是( )
A.△H2=△H1+△H3
B.1mol CuSO4(s)的总能量大于1mol Cu2+(aq)与1mol SO42-(aq)的总能量
C.△H2<△H1
D.从硫酸铜溶液中析出CuSO4·5H2O(s)的反应焓变△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是一种常见的过氧化物,具有强氧化性和漂白性。 通常可用作漂白剂和呼吸面具中的供氧剂。
(1)某实验小组通过下列实验探究过氧化钠与水的反应:

①用化学方程式解释使酚酞试液变红的原因___________________,依据实验现象推测红色褪去的原因是________________。
②加入MnO2的作用为_______________________。
(2)某实验小组拟验证CO2与Na2O2反应的产物,现设计以下实验装置进行实验:


①写出装置A中反应的化学方程式____________________;
②拟用装置D收集气体产物,请在方框中将装置补充完整______。
③产物检验:检验气体产物的方法:___________________;
④有同学认为该实验装置存在明显缺陷,你认为该缺陷是什么____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |

(1)实验装置中,仪器c的名称为__________________,作用为__________。
(2)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了________气体,继续滴加至液溴滴完。写出a中发生反应的化学方程式:__________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用__________;
③向分出的粗溴苯中加入少量的无水氯化钙(一种干燥剂),静置、过滤。加入无水氯化钙的目的是__________________。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,需进行的操作方法为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是
A. 饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
B. 25℃时,FeS的溶解度大于CuS的溶解度
C. 向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D. 向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、一氧化碳、辛烷、甲烷燃烧的热化学方程式分别为
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
O2(g)=8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是( )
A.H2B.COC.C8H18D.CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究KI 与Cu(NO3)2 的反应,进行实验一:

注: 本实验忽略Cu2+在此条件下的水解。
(1)取棕黄色清液,加入少量______溶液(试剂a),清液变为______色,说明生成了I2。
(2)探究生成I2的原因。
①甲同学进行如下实验: 向2mL Imol/LKI 溶液中加入1mL______溶液( 硝酸酸化,pH=1.5 ),再加入少量试剂a,观察到与(1)相同的现象。甲同学由此得出结论: 实验一中生成I2 的原因是酸性条件下,NO3- 氧化了I-。
②乙同学认为仅由甲同学的实验还不能得出相应结论。他的理由是该实验没有排除____氧化I-的可能性。
③若要确证实验一中是NO3-氧化了I-,应在实验一的基础上进行检验______的实验。
(3)探究棕黑色沉淀的组成。
①查阅资料得知: CuI 为难溶于水的白色固体。于是对棕黑色沉淀的组成提出两种假设:
a.CuI吸附I2; b.______吸附I2。
为证明上述假设是否成立,取棕黑色沉淀进行实验二:

已知: CuI难溶于CCl4;I2+2S2O32-=2I-+S4O62-(无色);Cu++2S2O32-=Cu(S2O3)23-(无色)。
由实验二得出结论: 棕黑色沉淀是CuI吸附I2 形成的。
②现象ⅲ为______________。
③用化学平衡移动原理解释产生现象ii 的原因:________________。
④由实验二可推知,Cu(NO3)2 与KI 反应过程中,一定发生的反应的离子方程式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com