
 2NH3(g);已知298 K时,
2NH3(g);已知298 K时,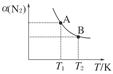

 2NH3(g)
2NH3(g) 2NH3,在该反应中,H2失去电子在阳极上发生氧化反应,其电极反应式为:3H2-6e-===6H+,则阴极电极反应式为“该反应的总式减去阳极电极反应式”得:N2+6e-+6H+===2NH3。
2NH3,在该反应中,H2失去电子在阳极上发生氧化反应,其电极反应式为:3H2-6e-===6H+,则阴极电极反应式为“该反应的总式减去阳极电极反应式”得:N2+6e-+6H+===2NH3。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:不详 题型:单选题
| A.H2与F2反应的热化学方程式为:H2(g)+F2(g)=2HF(g) ΔH=-541 kJ |
| B.44.8 L HF气体分解成22.4 L H2和22.4 L F2吸收541 kJ的热量 |
| C.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于541 kJ |
| D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.煤、石油、天然气均为化石燃料 | B.化石能源是非再生能源 |
| C.氢能、核能均是无污染的高效能源 | D.氢能是可再生能源 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④ | B.②③ | C.①④⑤ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
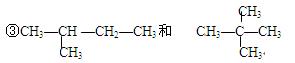
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com