
| A. | CO2(SO2):澄清石灰水 | B. | CO2(CO):通入氧气,并加热 | ||
| C. | Cl2(HCl):饱和碳酸钠溶液 | D. | Fe(Al):烧碱溶液 |
分析 A.二氧化碳能与氢氧化钙反应;
B.通入氧气引入新的杂质;
C.二氧化碳、HCl均与碳酸钠反应;
D.铝能与氢氧化钠溶液反应生成偏铝酸钠,而Fe不反应.
解答 解:A.二氧化碳能与氢氧化钙反应,将原物质除掉,故A错误;
B.通入氧气引入新的杂质,且少量的一氧化碳不燃烧,故B错误;
C.二氧化碳、HCl均与碳酸钠反应,将原物质除去,不符合除杂原则,故C错误;
D.铝能与氢氧化钠溶液反应生成偏铝酸钠,而Fe不反应,然后过滤即可,故D正确.
故选D.
点评 本题考查物质的分离、提纯和除杂等问题,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.


科目:高中化学 来源: 题型:解答题
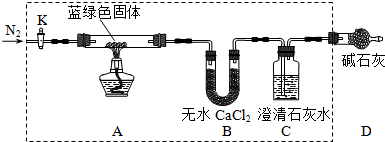
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
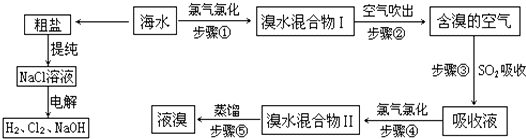
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 品红的分子式为C20H18N3 | |
| B. | 上述漂白原理反应属加成反应 | |
| C. | 碱性品红及与H2SO3生成的无色化合物都可与NaOH溶液反应 | |
| D. | 该无色化合物受热容易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研究化学反应中的能量变化,有利于通过改变反应条件,使同一反应消耗相同量的物质而放出更多的热,提高化学能的利用率 | |
| B. | 任何放热的化学反应,均可以利用原电池直接把化学能转化为电能 | |
| C. | 研究化学反应速率与化学平衡,有利于指导实际生产中达到“多,快,好,省”的生产效率 | |
| D. | 使用催化剂常常可以加快化学反应速率,但不能提高反应物的转化率,因此在实际生产中较少使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com