
分析 乙烯与溴发生加成反应,溴的四氯化碳溶液增加的质量为乙烯的质量,计算混合气体、乙烯的物质的量,进而计算甲烷的物质的量,再计算甲烷的质量,据此解答.
解答 解:乙烯与溴发生加成反应,溴的四氯化碳溶液增加的质量为5.6g,则:m(C2H4)=5.6g,n(C2H4)=$\frac{5.6g}{28g/mol}$=0.2mol,
而n(CH4)+n(C2H4)=$\frac{11.2L}{22.4l/mol}$=0.5mol,所以n(CH4)=0.5mol-0.2mol=0.3mol,故m(CH4)=0.3mol×16g/mol=4.8g,
故原混合气体中甲烷与乙烯的质量之比=4.8g:5.6g=6:7,
答:原混合气体中甲烷与乙烯的物质的量之比为3:2,原混合气体中甲烷与乙烯的质量之比为6:7.
点评 本题考查混合物计算,比较基础,关键是明确乙烯与溴发生加成反应确定乙烯的质量.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
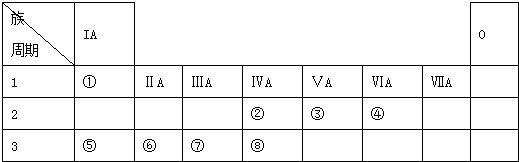
| 编号 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/10-10m | 0.77 | 0.99 | 1.86 | 0.75 | 1.17 | 1.02 | 1.43 | 0.71 | 1.52 | 0.89 |
| 最高正化合价 | +4 | +7 | +1 | +5 | +4 | +6 | +3 | +1 | +2 | |
| 最低负化合价 | -4 | -1 | -3 | -4 | -2 | -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、D2和T2互称为同素异形体 | B. | 35Cl和37Cl 互称为同位素 | ||
| C. |  和 和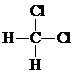 互称为同分异构体 互称为同分异构体 | D. | C2H4与C4H8一定能互称为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
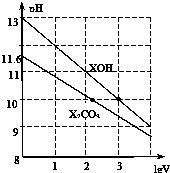 体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | XOH是强碱 | |
| B. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1×10-10•2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
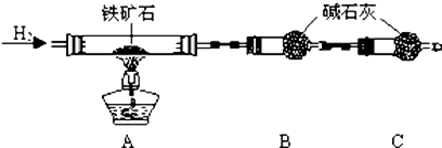
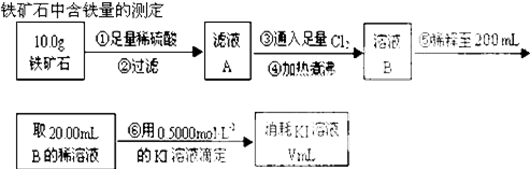
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟稀硫酸反应 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠跟水反应 Na+H2O═Na++OH-+H2↑ | |
| C. | 大理石跟稀盐酸反应 CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 氯气通入水中 Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com