
| 3 |
| 2 |
| 3 |
| 5 |
| 3 |
| 5 |
| 3 |
| 5 |
| 1 |
| 2 |
| 3 |
| 5 |
| 3 |
| 5 |
| x |
| (1.5=x)2��(1-x) |
| 0.5 |
| 0��52��0.5 |
| c(CH3OH) |
| c2(H2)c(CO) |
| 2c(CH3OH) |
| 2c(CO)c2(H2) |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| �۵�/�� | 801 | 714 | 190 | -70 |
| �е�/�� | 1 413 | 1 412 | 180 | 57.57 |
| A���٢� | B���ڢ� | C���٢ڢ� | D���ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����̼�������Һ�м���������ˮ��Ca2++2HCO3-+2OH-�TCaCO3��+CO32-+2H2O |
| B������������Һͨ������������壺2ClO-+SO2+H2O�T2HClO+SO32- |
| C����KI��ϡ����Ļ����Һ��ͨ��������4H++O2+4I-�T2I2+2H2O |
| D��С�մ���Һ�м������ʯ��ˮ��2HCO3-+Ca2++2OH-=CaCO3��+CO32-+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Cl-�ʻ���ɫ |
| B��Cl-�ж� |
| C��Cl-���������� |
| D��Cl-���ȶ��ṹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
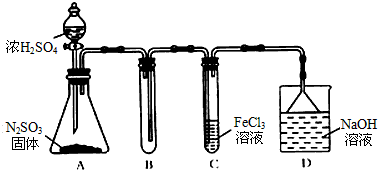
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
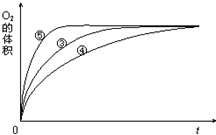 ijʵ��С����H2O2�ֽ�Ϊ�����о�Ũ�ȡ���������Һ����ԶԷ�Ӧ���ʵ�Ӱ�죮�ڳ����°������·������ʵ�飮
ijʵ��С����H2O2�ֽ�Ϊ�����о�Ũ�ȡ���������Һ����ԶԷ�Ӧ���ʵ�Ӱ�죮�ڳ����°������·������ʵ�飮| ʵ���� | ��Ӧ�� | ���� |
| �� | 10mL2% H2O2��Һ | �� |
| �� | 10mL5% H2O2��Һ | �� |
| �� | 10mL5% H2O2��Һ | 1mL0.1mol?L-1FeCl3��Һ |
| �� | 10mL5% H2O2��Һ+����HCl��Һ | 1mL0.1mol?L-1FeCl3��Һ |
| �� | 10mL5% H2O2��Һ+����NaOH��Һ | 1mL0.1mol?L-1FeCl3��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ǿ�� |
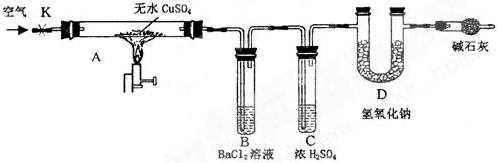
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����������ǻ�ԭ�� |
| B��ά����C������ԭ��Ӧ |
| C��άC��Fe3+ת����Fe2+ |
| D������������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com