
 .
. 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
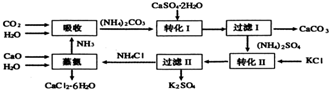
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

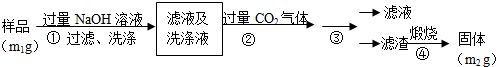
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量是98 g | |
| B. | 1 mol CO2的体积是22.4 L | |
| C. | 0.2 mol H2O的质量是3.6 g | |
| D. | 0.1 mol/LFeCl3溶液中,C1-的物质的量浓度为0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
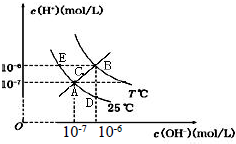
| A. | 图中五点Kw间的关系:B>C>A=D=E | |
| B. | E 点对应的水溶液中,可能有NH 4+、Ba 2+、Cl-、I-大量同时存在 | |
| C. | 若0.1 mol/L 的NaHA 溶液水溶液中c(H+)与c(OH-)关系如图D 点所示,则溶液中有:c(HA-)>c(OH-)>c(A2- )>c(H2A) | |
| D. | 向NaHSO4溶液中滴入Ba(OH)2溶液,当c(H+)与c(OH-)关系如图A 点所示,则溶液中反应:2H++SO4 2-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
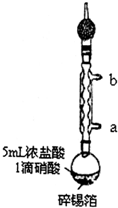 实验室制备无水二氯化锡的主要步骤如下:
实验室制备无水二氯化锡的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的体积:V乙≤10V甲 | |
| B. | 若分别与5mlpH=11的NaOH溶液反应,所得溶液的pH:甲≤乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 | |
| D. | 水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素 | |
| B. | 用于人民币票面文字等处的油墨中所含有的氧化铁是一种磁性物质 | |
| C. | 防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料 | |
| D. | 某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是淀粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com