
| A. | 钾 | B. | 钙 | C. | 铬 | D. | 铜 |
分析 根据构造原理写出各元素的核外电子排布式,得出第四周期元素中最外层电子排布式为4s1的有K、Cr或Cu,据此分析.
解答 解:A.钾的核外电子排布式为1s22s22p63s23p64s1,最外层电子排布为4s1,故A错误;
B.钙的核外电子排布式为1s22s22p63s23p64s2,最外层电子排布为4s2,故B正确;
C.铬的核外电子排布式为1s22s22p63s23p63d54s1,最外层电子排布为4s1,故C错误;
D.铜的核外电子排布式为1s22s22p63s23p63d104s1,最外层电子排布为4s1,故D错误;
故选B.
点评 本题考查了原子的最外层电子排布式,根据电子排布式确定,属于基础知识,题目难度不大.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:填空题
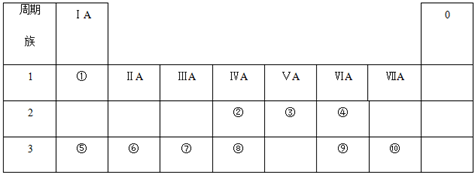
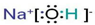
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
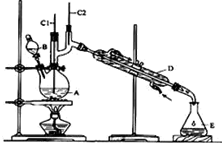 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:CH3CH2CH2CH2OH$→_{H_{2}SO_{4}△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO| 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子结构示意图 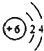 ,可以表示12C原子或13C原子 ,可以表示12C原子或13C原子 | |
| B. | 乙烯的结构简式:CH2CH2 | |
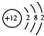
| C. | 次氯酸的电子式 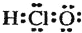 | |
| D. | CO2的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向原溶液中通入常温常压下的HCl气体22.4V L,使其完全溶解 | |
| B. | 将溶液加热浓缩到0.5V L | |
| C. | 向原溶液中加入10.00 mol•L-1的盐酸0.2V L,再稀释至1.5V L | |
| D. | 向原溶液中加入V L 3 mol•L-1的盐酸混合均匀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com