
【题目】某有机物的结构为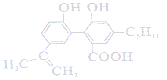 ,下列说法正确的是( )
,下列说法正确的是( )
A. 1 mol该有机物最多可以与7 mol H2发生加成反应
B. 该有机物可以发生取代、加成、氧化、水解等反应
C. 0.1 mol该有机物与足量金属钠反应最多可以生成3.36L H2
D. 与该有机物具有相同官能团的同分异构体共有8种(不考虑立体异构)
【答案】A
【解析】
该物质中含有酚羟基、碳碳双键和羧基,具有酚、烯烃、羧酸性质,能发生加成反应、取代反应、显色反应、加聚反应、酯化反应等。
A.苯环和碳碳双键都能和氢气发生加成反应,则1mol该有机物最多可与7mol H2发生加成反应,选项A正确;
B.该分子不含酯基或卤原子,所以不能发生水解反应,酚羟基和羧基能发生取代反应,苯环及碳碳双键能发生加成反应,碳碳双键和酚羟基能发生氧化反应,选项B错误;
C.虽然分子中含有二个酚羟基和一个羧基,但没有说明标准状况下,产生的气体体积无法计算,选项C错误;
D.分子中含有戊基-C5H11,戊基有8种,且其他基团在苯环上的位置还有多种,故该有机物具有相同官能团的同分异构体一定超过8种,选项D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】(1)200mL2mol/L的Al2(SO4)3溶液中SO42-的物质的量浓度为___;
(2)标准状况下,36gH2和O2组成的混合气体的体积是67.2L,则混合气体中H2和O2的体积比为___;
(3)标准状况下,将33.6LNH3溶于水配成500mL溶液,该溶液的物质的量浓度为___;
(4)已知1.505×1023个A气体分子的质量为31g,则A气体的摩尔质量是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在2L的密闭容器中放入4mol N2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为_________;5min时,N2O5在混合气体中的体积分数是____。
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为_________;5min时,N2O5在混合气体中的体积分数是____。
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:

①该反应的化学方程式为______。
②若X、Y、Z均为气体,2min时反应达到平衡,此时体系内压强与开始时的压强之比为____。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时__(填“增大”“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +3、+5、 |
|
下列叙述正确的是
A.X、Y的单质与稀盐酸反应速率X<Y
B.一定条件下,W单质可以将Z从其氢化物中置换出来
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.常温下,Z单质与W的常见单质直接生成ZW2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属制品进行抗腐蚀处理,可延长其使用寿命。以下为铝材表面处理的一种方法:
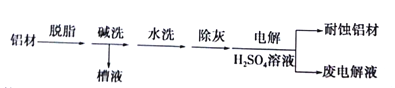
(1)碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是______(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列中的______。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
(2)以铝材为阳极,在![]() 溶液中电解,铝材表面形成氧化膜,阳极电极反应式为______
溶液中电解,铝材表面形成氧化膜,阳极电极反应式为______
取少量废电解液,加入![]() 溶液后产生气泡和白色沉淀,产生沉淀的原因是______(用化学用语回答)
溶液后产生气泡和白色沉淀,产生沉淀的原因是______(用化学用语回答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中___(填“s”、“p”、“d”或“ds”)区。[Ag2(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是___。
(2)下表是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1 mol该配离子中含σ键数目为____。
②该配合物中存在的作用力类型有_____(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO2的熔点(1660℃C)比MnS的熔点(1610℃)高,其主要原因是_________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。
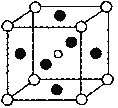
①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于____位置,X处于____位置。
③CH3NH3PbI3晶体的晶胞参数为anm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应达到化学平衡,加压或降温都能使化学平衡向逆反应方向移动的是
A. 2NO2![]() N2O4(正反应为放热反应) B. C(s)+CO2
N2O4(正反应为放热反应) B. C(s)+CO2![]() 2CO(正反应为吸热反应)
2CO(正反应为吸热反应)
C. N2+3H2![]() 2NH3(正反应为放热反应) D. H2S
2NH3(正反应为放热反应) D. H2S![]() H2+S(s)(正反应为吸热反应)
H2+S(s)(正反应为吸热反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物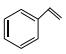 (甲)、
(甲)、![]() (乙)、
(乙)、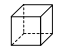 (丙)的分子式均为
(丙)的分子式均为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A. 甲的同分异构体只有乙和丙两种
B. 甲、乙、丙的一氯代物种数最少的是丙
C. 甲、乙、丙均可与溴的四氯化碳溶液反应
D. 甲中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)在1~18号元素中,除稀有气体元素外,原子半径最大的是元素是__________,电负性最大的元素是__________(用元素符号表示)。
(2)某元素的![]() 轨道上有1个未成对电子,该元素为__________(用元素符号表示)。
轨道上有1个未成对电子,该元素为__________(用元素符号表示)。
(3)某元素原子的价电子排布式为![]() ,它在周期表中的位置是__________,其最高正化合价是__________。
,它在周期表中的位置是__________,其最高正化合价是__________。
(4)某元素的激发态(不稳定状态)原子的电子排布式为![]() ,该元素基态原子的电子排布式为__________。
,该元素基态原子的电子排布式为__________。
(5)日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素.该元素的外围电子排布为![]() 该元素的名称为__________,它在元素周期表中位于__________区。
该元素的名称为__________,它在元素周期表中位于__________区。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com