


科目:高中化学 来源: 题型:
| A、反应后溶液pH下降 |
| B、通常用盐酸酸化的高锰酸钾溶液 |
| C、方框中粒子为NO2 |
| D、当生成1 mol Mn2+ 需消耗2.5 mol NO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在CCl4、PCl5、CS2分子中所有原子都满足最外层为8个电子稳定结构 |
| B、三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,因此三氯化铁晶体是分子晶体 |
| C、Na3N与NaH均为离子化合物,都能与水反应放出气体,且与水反应所得溶液均能使酚酞试液变红 |
| D、SO2、H2O都是由极性键形成的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
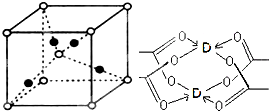
| 电离能 | I, | I2 | I3 | U | I5 | h | I7 |
| (KJ.mol-1) | 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 | ||
| B、若金属全部溶解,则溶液中一定含有Fe3+ | ||
| C、若金属全部溶解,且产生336mL气体(标准状况),则b=0.3 | ||
D、当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b<80y(1-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
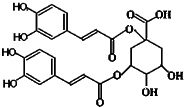 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)( )
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是(连四个不同基团的碳属于手性碳)( )| A、分子中含有6个手性碳原子 |
| B、一定条件下能发生酯化反应和消去反应 |
| C、不能与氯化铁溶液发生显色反应 |
| D、1 mol洋蓟素最多可与11 mol NaOH反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com