
| A. | Na | B. | Cu | C. | Fe | D. | Al |
分析 单质与足量的硫的反应属于化合反应,因此质量增加1.6g都是S的质量,则S的物质的量为$\frac{1.6g}{32g/mol}$=0.05mol,根据金属和硫发生反应的方程式来判断回答.
解答 解:单质与足量的硫的反应属于化合反应,因此质量增加1.6g都是S的质量,则S的物质的量为$\frac{1.6g}{32g/mol}$=0.05mol,
A、发生的反应为:2Na+S=Na2S;
B、发生的反应为:2Cu+S=Cu2S;
C、发生的反应为:Fe+S=FeS;
D、发生的反应为:2Al+3S=Al2S3;
当某单质为0.1mol时,消耗S为0.05mol,那么只有Na、Cu满足.
故选AB.
点评 本题考查学生硫和金属之间的反应情况,注意硫和金属反应生成的是低价金属的硫化物,可以根据教材知识来回答,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 待测溶液的 体积/mL[ | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁条失火可以用CO2进行扑灭 | B. | 镁不能与稀硫酸反应放出H2 | ||
| C. | 镁制容器可以盛放浓硝酸 | D. | 镁在空气中燃烧产物并不全是MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4 Br2 Fe3+ Cu2+ | B. | 浓H2SO4 Cu2+Fe3+ Br2 | ||
| C. | Br2 浓H2SO4 Fe3+Cu2+ | D. | Fe3+ Cu2+ Br2 浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
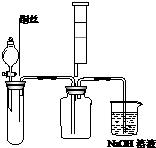 (1)某同学为了证明并观察到铜与稀硝酸反应的产物NO,实验时首先向下图试管中加入一定量的块状固体,再滴加过量的稀硝酸,待反应产生的气体充满试管后,再将铜丝插入稀硝酸溶液中.你认为试管中的块状固体是碳酸钙,其作用是赶走试管中的空气,实验结束时,用注射器向试管内推入氧气(或空气)的目的是检验NO,观察到红棕色气体.
(1)某同学为了证明并观察到铜与稀硝酸反应的产物NO,实验时首先向下图试管中加入一定量的块状固体,再滴加过量的稀硝酸,待反应产生的气体充满试管后,再将铜丝插入稀硝酸溶液中.你认为试管中的块状固体是碳酸钙,其作用是赶走试管中的空气,实验结束时,用注射器向试管内推入氧气(或空气)的目的是检验NO,观察到红棕色气体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com