
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150ml 4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A. 0.21 mol
B. 0.25 mol
C. 0.3 mol
D. 0.35 mol
 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
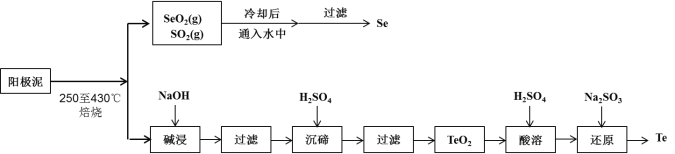
已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)Se在周期表中的位置为____________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有2 mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(3)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(4)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为_______________________________________。
(5)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是_______________________________________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),请通过计算说明_____________________________。(已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.5×10-7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl 据此,某学生设计了下列实验。
(制备NaClO溶液)
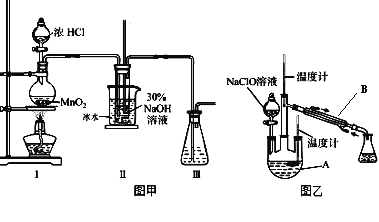
实验装置如图甲所示部分夹持装置已省略
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
(1)请写出肼的电子式_________________。
(2)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有___________。
(3)装置I中发生的化学反应方程式是 ____________________________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的是______________________________。
(制取水合肼)
实验装置如图乙所示。
(4)仪器B的名称为_________;反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,请写出该反应的化学反应方程式_________________。
(5)充分反应后,加热蒸馏烧瓶A内的溶液即可得到水合肼的粗产品。若在蒸馏刚刚开始的时候忘记添加沸石,应该采取的操作是_____________________。
(测定肼的含量)
称取馏分0.2500g,加水配成20.00mL溶液,在一定条件下,以淀粉溶液做指示剂,用0.1500 mol·L-1的I2溶液滴定。
已知:N2H4·H2O+2I2==N2↑+4HI+H2O
滴定终点时的现象为_____________________________________。实验测得消耗I2溶液的平均值为20.00 mL,馏分中N2H4.H2O的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同质量的铝分别投入足量的下列物质中反应生成氢气,消耗溶质物质的量最少的是
A. 稀硫酸 B. 稀盐酸 C. 氢氧化钡溶液 D. 氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关糖类、脂肪和蛋白质的叙述正确的是( )
A.糖类都能表示为Cm(H2O)n
B.糖类和脂肪都是储能物质
C.脂肪由脂肪酸和甘油构成,所以脂肪是一种高分子化合物
D.糖类、脂肪和蛋白质都能氧化分解释放能量供给生物利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是
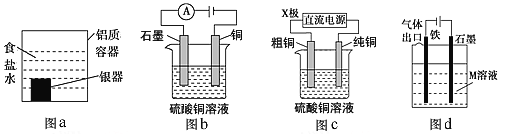
A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
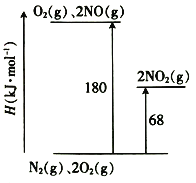
【题目】NO、NO2是汽车尾气中主要的含氮氧化物。回答下列问题:
(1)已知氮氧化物转化过程中的能量变化如图(图中表示生成2 mol NO2的能量变化)。1 mol NO氧化为NO2的焓变△H=___________。
(2)某温度下,反应的平衡常数如下:
a.2NO2(g) ![]() N2(g)+2O2(g) K=6.7×1016
N2(g)+2O2(g) K=6.7×1016
b.2NO(g) ![]() N2(g)+O2(g) K=2.2×1030
N2(g)+O2(g) K=2.2×1030
分解反应趋势较大的反应是__________(填“a”或“b”);反应2NO(g)+O2(g) ![]() 2NO2(g)的K=_____________。
2NO2(g)的K=_____________。
(3)已知反应2NO(g)+O2(g) ![]() 2NO2的正反应速率v正=k1Cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
2NO2的正反应速率v正=k1Cm(NO)cn(O2),其中k为速率常数,可通过下列实验数据计算k、m、n。
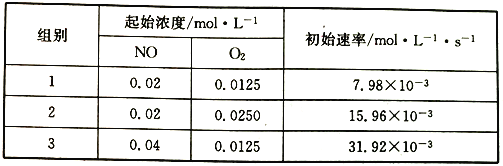
则k1=______________,m=______________,n=______________,
(4)已知该反应的历程为:
第一步:NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步:N2O2+O2![]() 2NO2慢反应
2NO2慢反应
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:v(正)=k1c2(NO),v(逆)=k-1c(N2O2)。下列叙述正确的是________(填字母)。
A.第一步反应的平衡常数K=![]()
B.v(第一步的正反应)<v(第二步的反应)
C.第二步的活化能比第一步的活化能高
D.第二步中N2O2与O2的碰撞100%有效
(5)一定条件下测得容器中NO、O2、NO2浓度发生如下变化。
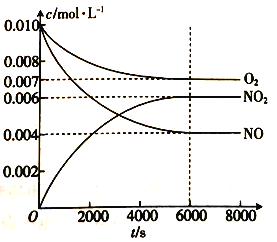
①NO的平衡转化率为 _______________。
②该温度下反应2NO(g)+O2(g)![]() 2NO2(g)的平衡常数为______________(保留整数)
2NO2(g)的平衡常数为______________(保留整数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com