
| A、Cl2与水反应 |
| B、CO还原氧化铁 |
| C、过氧化钠与CO2反应制O2 |
| D、钠与水反应 |
| ||


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
 A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大.A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满.用化学式或化学符号回答下列问题:
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大.A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子.B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满.用化学式或化学符号回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠溶液滴入酚酞变红:CO32-+2H2O?H2CO3+2OH- |
| B、铜溶解于氯化铁溶液中:2Fe3++3Cu═2Fe+3Cu2+ |
| C、氯化铝溶液与过量的氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、FeSO4溶液中滴入稀硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 |
| B、在入海口的钢闸门上装一定数量的铜块可防止闸门被腐蚀 |
| C、先通入氯气,再加入硫酸亚铁处理水,能达到消毒杀菌和除去悬浮杂质的目的 |
| D、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下22.4LH2中含有的氢分子的个数为NA |
| B、1L1mol/L的KClO3溶液中含有的Cl-个数为NA |
| C、凡是溶于水能导电的化合物就是电解质 |
| D、某溶液中滴加烧碱溶液,加热产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定存在NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢铵溶液和足量氢氧化钠溶液混合,反应的离子方程式为:HCO3-+OH-═CO32-+H2O |
| B、25℃时,pH=8的0.1mol?L-1NaX溶液中由水电离出的c(OH-)=1×10-8mol?L-1 |
| C、等物质的量浓度的NH4Cl溶液和NH3?H2O溶液中,c(NH4+)前者小于后者 |
| D、等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 实验 | 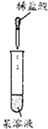 | 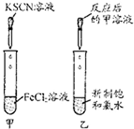 |  | 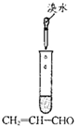 |
| 现象 | 出现白色沉淀 | 甲、乙中溶液均未变红 | 苯中不褪色,甲苯在褪色 | 溶液褪色 |
| 结论 | 原溶液可能含Ag+或SiO32- | 氯水可能氧化SCN- | 甲苯中甲基易被氧化 | 可证明分子中含碳碳双建 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32g氧气和28g CO和N2的混合气体,含为原子数目相等 |
| B、等物质的量浓度的盐酸和硫酸,H+的物质的量浓度相等 |
| C、在常温常压下,11.2L氯气的分子数为0.5NA |
| D、把40g NaOH固体溶于1L水中,所得NaOH溶液的物质的量浓度为1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:


| 时间(min) | 0 | 2 | 4 | 6 | 8 |
| c(HI)mol?L-1 | 8.0 | 5.0 | 3.0 | 2.0 | 2.0 |
| c(H2)mol?L-1 | 0 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com