
氯碱工业中电解饱和食盐水的原理示意图如下图所示:

(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42->c(Ca2+)]。精致流程如下(淡盐水和溶液A来自电解池):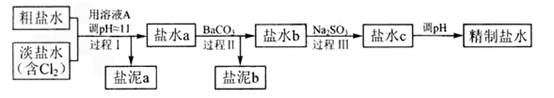
①盐泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是 。 ③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有 。
(1)NaOH
(2)2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(3)氯气和水反应,Cl2+H2O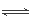 HCl+HClO,增大HCl的浓度可使平衡向逆向移动,减少氯气在水中的溶解度,有利于氯气的溢出。
HCl+HClO,增大HCl的浓度可使平衡向逆向移动,减少氯气在水中的溶解度,有利于氯气的溢出。
(4)①Mg(OH)2 ②2NH4++3Cl2+8OH-=8H2O+6Cl-+N2↑ ③SO42- Ca2+
【解析】(1)电解时,阴极H+放电,阳极Cl-放电,因此溶液中溶质是NaOH。
(2)电解饱和食盐水的离子方程式为2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(3)因为阳极上产生Cl2,而氯气能溶解于水,产能发生Cl2+H2O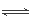 HCl+HClO,根据平衡移动原理知,增大盐酸的浓度可使平衡向逆向移动,这样减少了氯气的溶解度,有利于氯气的溢出。
HCl+HClO,根据平衡移动原理知,增大盐酸的浓度可使平衡向逆向移动,这样减少了氯气的溶解度,有利于氯气的溢出。
(4)由于溶解中含有Mg2+,所以用NaOH调节溶液的pH时,会产生Mg(OH)2沉淀,即盐泥a中还含有Mg(OH)2。淡盐水中含有氯气,氯气具有强氧化性,
可将NH4+氧化为N2,而氯气被还原成Cl-,方程式为2NH4++3Cl2+8OH-=8H2O+6Cl-+N2↑;沉淀转化的实质是沉淀溶解平衡的移动,一般说来,溶解度相对大的容易转化为溶解度更小的沉淀,加入BaCO3后,溶液中的SO42-更容易生成更难溶的BaSO4沉淀,由于Ca2+的存在,还会生成CaCO3沉淀。


科目:高中化学 来源:2014高考名师推荐化学无机物性质及应用(金属)(解析版) 题型:选择题
下列有关叙述中正确的是
A.Mg和Al都可以用电解法冶炼得到
B.Na2O2、Na2O组成元素相同,与CO2反应产物也相同
C.用过量的KSCN溶液除去FeCl2溶液中的少量FeCl3
D.Mg和Fe在一定条件下与水反应都生成H2和对应的碱
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学常见仪器的使用(解析版) 题型:选择题
关于下列各实验装置的叙述中,不正确的是

A.装置①可用于实验室制取少量NH3或O2
B.可用从a处加水的方法检验装置②的气密性
C.实验室可用装置③收集H2、NH3
D.利用装置④制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学工业流程图分析(解析版) 题型:填空题
工业上由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备无水AlCl3的流程如下:
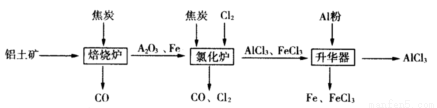
已知:AlCl3,FeCl3,分别在183℃、315℃升华
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3时转移______mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为_______。在温度约为700℃向升华器中加入铝粉,发生反应的化学方程式为 。充分反应后温度降至_____以下(填“183℃、315℃之一),开始分离收集AlCl3。
②将AlCl3· 6H2O溶于浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的 (填字母序号)。
①氧化性 ②吸水性 ③难挥发性 ④脱水性
a.只有① b.只有② c.只有②③ d.只有②③④
(3)海洋灯塔电池是利用铝、石墨为电极材料,海水为电解质溶液,构成电池的其正极反应式________,与铅蓄电池相比.释放相同电量时,所消耗金属电极材料的质量比m(Al): m(Pb)=__________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验药品保存、基本操作、检验(解析版) 题型:选择题
下列有关实验原理或实验操作正确的是
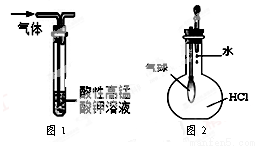
A.用干燥pH试纸测定某新制氯水的pH
B.用图1装置能除去SO2中混有的CO2
C.用图2装置能验证HCl气体在水中的溶解性
D.用25 mL碱式滴定管量取20.00 mLKMnO4溶液
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验药品保存、基本操作、检验(解析版) 题型:选择题
下列操作不能达到目的的是
选项 | 目的 | 操作 |
A | 配制100mL1.0mol/L CuSO4溶液 | 将25gCuSO4·5H2O溶于100mL蒸馏水中 |
B | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
C | 在溶液中将MnO4-完全转化为Mn2+ | 向酸性KMnO4溶液中滴加H2O2溶液至紫色消失 |
D | 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学守恒及离子浓度大小的比较(解析版) 题型:选择题
下列物质的量浓度关系错误的是
A.等物质的量浓度的HA溶液与MOH溶液等体积混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHCO3溶液:c(Na+)>c(OH-)>c( )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学原电池的工作原理、电极反应式的书写(解析版) 题型:选择题
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水”电池在海水中放电时的有关说法正确的是
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com