
ʵ���ҴӺ����Һ����H2O�⣬������CCl4��I2��I�����л��յ⣬��ʵ�������ͼ1��
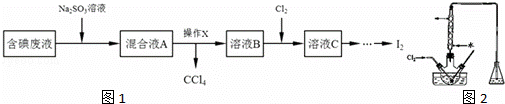
��1�����Һ�м����Թ�����Na2SO3��Һʱ���������ӷ���ʽΪ�����ò�����Ŀ����������
��2������XӦ����������д��������ͼ2���н��У������õ���ҺB�Ĺ��̣��������Һ���ú�����
��3��������ƿ�н���ҺB���������pHԼΪ2������ͨ��Cl2����40˚C���ҷ�Ӧ��ʵ��װ������ͼ��ʾ����ʵ������ڽϵ��¶��½��е�ԭ������������ƿ��ʢ�ŵ���ҺΪ�����������ʵĻ�ѧʽ����
��4��ij�����ˮ��pHԼΪ4����һ������I2�����ܴ���I����IO3��������ʹ�����������ʵĻ�ѧʽ����ͬ����Һ������ܴ��ڵ�I����������Һ������ܴ��ڵ�IO3�����ڼ���ú����ˮ���Ƿ���I����IO3��ǰ����Ҫ���еIJ���������������ţ���
a��ȡ���������ˮ��CCl4�����ȡ����Һ
b����NaOH��Һ����Һ���ڵ�����
c������Һ�е�������������Һ��
| ���ʷ�����ᴿ�ķ����ͻ��������ۺ�Ӧ�ã� | |
| ר�⣺ | ʵ������⣮ |
| ������ | ��1������������ԣ������������������������ƣ���������ԭ���ɵ⣻�ⲻ��������ˮ����������������ˮ�� ��2�����뻥�����ܵ�Һ����÷�Һ�ķ������룬��Ϸ�ũҵʵ�������������ش�õ���Һ�ķ����� ��3���������������������ܽ�������¶ȵ����߶���С�����������������ܺ�����������Һ��Ӧ���������ʣ� ��4�������Ӿ��л�ԭ�ԣ��ܱ��������������ɵ⣬��������Ӿ��������ԣ��ܱ���ԭ����ԭ���ɵ⣬����������Һ����ɫ�� |
| ��� | �⣺��1������������ԣ������������������������ƣ���������ԭ���ɵ⣬���ӷ�Ӧ����ʽΪSO32��+I2+H2O=2I��+2H++SO42�����ⲻ��������ˮ����������������ˮ��Ϊ��ʹ�����IԪ�ؽ���ˮ��ҺӦ���ԭΪ�����ӣ� �ʴ�Ϊ��SO32��+I2+H2O=2I��+2H++SO42����ʹ���Ȼ�̼�еĵ����ˮ�㣻 ��2�����Ȼ�̼�����л��ˮ����������߲����ܣ����뻥�����ܵ�Һ����÷�Һ�ķ������룬���Է�������Ȼ�̼���÷�Һ�ķ�����ʵ������Ϊ��Һ©�����õ���Һ�IJ���Ϊ���������Һ���ú�Һ©���ϲ����ӣ������������ų��²�Һ�壮���²�Һ����ȫ����رջ��������ϲ�����ʣ��Һ�壻 �ʴ�Ϊ����Һ©�����������Һ���ú�Һ©���ϲ����ӣ������������ų��²�Һ�壮���²�Һ����ȫ����رջ��������ϲ�����ʣ��Һ�壻 ��3���������������������ܽ�������¶ȵ����߶���С���¶�Խ�ߣ��������ܽ��ԽС����ӦԽ����֣�����Ӧ���ڵ��������½��з�Ӧ�����������������ж�������ֱ���ſգ��Ҷ��ܺ�����������Һ��Ӧ���������ʣ�������NaOH��Һ���������͵������� �ʴ�Ϊ��ʹ��������Һ���нϴ���ܽ�ȣ����ֹ���������ֹ���һ������������NaOH��Һ�� ��4�������Ӿ��л�ԭ�ԣ��ܱ��������������ɵ⣬��������Ӿ��������ԣ��ܱ���ԭ����ԭ���ɵ⣬����������Һ����ɫ����������鷽��Ϊ�� ��ˮ��ȡ������Һ������1��2mL������Һ�����������ữ���μ�FeCl3��Һ��2I��+2Fe3+=2Fe2++I2������Һ����ɫ��˵����ˮ�к���I��������I���� ����ˮ��ȡ������Һ������1��2mL������Һ���������ữ���μ�Na2SO3��Һ��5SO32��+2 IO3��+2H+=I2+5SO42��+H2O������Һ����ɫ��˵����ˮ�к���IO3��������IO3�����ڼ���ú����ˮ���Ƿ���I����IO3��ǰ����Ҫ���еIJ�����ȡ���������ˮ��CCl4�����ȡ����Һ������Һ�е�������������Һ�����Ƿ������֤���ӵĴ��ڣ� �ʴ�Ϊ��FeCl3 ��Na2SO3��ac�� |
| ������ | ���������ʵ��Ʊ�Ϊ���忼����������ԭ��Ӧ�����ӵļ��顢���ʵķ�����ᴿ����ȷ���ʵ������ǽⱾ��ؼ����������ʵ��������ʡ�����������ᴿ������ѡȡ�ȷ������������֪����ļ��鷽������Ŀ�Ѷ��еȣ� |
��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��AlCl3��NaCl�Ļ����ҺVL���������ֳ����ݡ�һ�ݵμӰ�ˮ��ʹAl3+������ȫ��������һ�ݵμ�AgNO3��Һ��ʹCl��������ȫ��������Ӧ������a mol NH3��H2O��b mol AgNO3���ݴ˵�֪ԭ�����Һ�е�c(Na+) ��mol/L��Ϊ
A�� (2b-4a)/V
(2b-4a)/V  B��(b-a)/V C��(2b-2a)/V D����b-2a��/V
B��(b-a)/V C��(2b-2a)/V D����b-2a��/V
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ˮ����������������ܹ㷺���ڷ��������졢����꾮����ָߵ�Ϳ���С���ˮ�����й躬���IJⶨ���Բ��÷���������������䲽��Ϊ��
�ٳ�ȡ�����ܽ��ں��й����ķ����Ӻͼ����ӵ�ǿ����Һ�У�����������ӡ��������������ɷ�����أ�K2SiF6��������
�ڳ������������ˮ��ˮ�⣬����HF��H2SiO3��KF��
�۹��˳�ȥ������������������Ʊ���Һ�ζ���Һ��
��1������������е�ˮ�ⷴӦ����ʽΪ�� �� ����
������з�Ӧ�����ӷ���ʽΪ���� �� ����
��2���ڲ�����У����ζ�ǰδ���������Ʊ���Һ��ϴ�ζ��ܣ����õĹ�Ԫ�غ�����
�� �� ��(�ƫ�ߡ�����ƫ�͡����䡱)��
��3����ÿ�γ�ȡ����������Ϊ1.00g���ظ��ζ��ĴΣ�����1.00 mol��L��1�������Ʊ���Һ�����Ϊ�ֱ�Ϊ16.80mL��19.90mL��20.00mL��20.10mL���Լ���������й�Ԫ�ص������������Զ�������ƣ���д��������̡��� �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�еļ��֣�����ˮ �������c��H+��=1��lO��13 mol/L���������Һ�л���ͨ��һ������Cl2����Һ����ɫ ��Ϊ��ɫ�������йط�����ȷ���ǣ�������
| �� | A�� | ��Һ��pH=1��13 | B�� | ��Һ��һ��û��Fe3+��Na+ |
| �� | C�� | ��Һ����������I��������ȷ��HCO3�� | D�� | ��Cl2������������Һֻ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
˫����ͨ���з���2NO2⇌N2O4+Q��Q��0������ͬʱ�����ձ��зֱ������¡������������ˮ����0.1mol/L H2O2��Һ���ң��������Ҳ��ձ��м�������Fe2��SO4��3������������й��ƶ�����ȷ���ǣ�������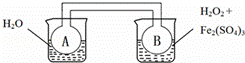
| �� | A�� | ʵ��ʱ��A��B�е�ѹǿʼ����� |
| �� | B�� | ���Ҳ��ձ��������ȷ�Ӧ����A�и���ﵽƽ�� |
| �� | C�� | ���Ҳ��ձ��������ȷ�Ӧ����A����ɫ���� |
| �� | D�� | ���ø�װ���ƶ��Ҳ��ձ��з�Ӧ����ЧӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ȡ����ˮ��ʵ��װ���������˵���У�����ȷ����(����)
A������һ����Ҫ�¶ȼ�
B���������е�ˮ�������Ǵ��¿ڽ��룬�Ͽ��ų�
C��ʵ������Ҫ������ƿ�м��뼸�����Ƭ����ֹ���ֱ�������
D��������ƿ�����ʯ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ʱ����һ���¸ҵ�С������Ȣ����Ů��——�����Ĺ���������������ѣ����е�һ�������ǣ�10 kgС���Ƕ�������С���Ӻܿ���뵽�˽���������İ취��˳����Ȣ���˹��������ܲ����뵽С�����뵽��ʲô������______________________________________��
�������ַ���������Ҳ��������һ�����������ٶ�һ�����������ж��ٸ�������ô���Ǿ��ܺܺõؽ�������ʺ���������ϵ�����������������________________�����Ļ���________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
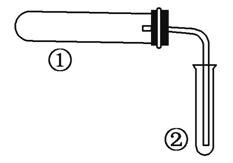
����ͼװ��(�г֡�����װ������)����ʵ�飬�ɢ���������֤ʵ���з�Ӧ��������(����)
| ѡ�����ʵ�� | �������� | |
| A | ������ˮ�������� | ����ˮð�� |
| B | ����NH4Cl��Ca(OH)2����� | ��̪��Һ��� |
| C | NaHCO3�������ȷֽ� | ����ʯ��ˮ����� |
| D | ʯ���������Ƭ�����ȷֽ� | Br2��CCl4��Һ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ܱ������н������·�Ӧ��H2(g)��I2(g)  2HI(g)�����¶�T1��T2ʱ����������뷴Ӧʱ��Ĺ�ϵ����ͼ��ʾ������ͼʾ����ȷ�ж�������
2HI(g)�����¶�T1��T2ʱ����������뷴Ӧʱ��Ĺ�ϵ����ͼ��ʾ������ͼʾ����ȷ�ж�������
A��T1>T2����H>0 B��T1>T2����H<0
C��T1<T2����H>0 D��T1<T2����H<0
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com