
【题目】乙酸是一种重要的有机酸,在工业合成和医学上有重要的用途。
回答下列问题:
(1)乙酸俗称______________。
(2)CH3COOH(I)、C(s)、H2(g)的燃烧热△H分别为-870.3kJ·mol-1、-393.5 kJ·mol-1、-285.8 kJ·mol-1,则反应2C(s)+2H2(g)+O2(g)=CH2COOH(I)的△H=______________。
(3)乙酸和乙酸钠按一定比例混合可制成治疗酸中毒或碱中毒的缓冲溶液。
①用离子方程表示该缓冲溶液能治疗碱中毒的原因:____________________________。
②常温下,体积为1L,浓度为0.1mol·L-1的乙酸电离度为1.3%,该温度下乙酸的电离平衡参数值为__________________(水的电离忽略不计,结果保留两位有效数字);向该溶液中加入_______molCH3COONa可使溶液的pH约为4(溶液体积变化忽略不计)。
(4)已知乙酸蒸气中存在乙酸二聚物,二者如下平衡:(CH3COOH)2(g)![]() 2CH3COOH(g) △H。
2CH3COOH(g) △H。
实验测定该平衡体系的![]() 随温度和压强的变化如图所示:
随温度和压强的变化如图所示:

①上述反应的△H_____(填“>”或“<”)0,a、b、c三点中平衡常数最大的点是______。
②测定乙酸的摩尔质量应选择的适宜条件是________________。
【答案】 醋酸 -488.3kJ·mol-1 CH3COOH+OH-=CH3COO-+H2O 1.7×10-3 1.7×10-5 > b 低压、高温
【解析】(1)乙酸俗称醋酸;
(2)25℃、101kPa下,H2(g)、C(s)和CH3COOH(l)的燃烧热分别是285.8kJmol-1、393.5kJmol-1和870.3kJmol-1,
则H2(g)+![]() O2(g)=H2O(l)△H=-285.8kJmol-1①,
O2(g)=H2O(l)△H=-285.8kJmol-1①,
C(s)+O2(g)=CO2(g)△H=-393.5kJmol-1②,
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJmol-1③,
由盖斯定律可知,①×2+②×2-③可得反应2C(s)+2H2(g)+O2(g)=CH3COOH(1),其反应热△H=2×(-285.8kJmol-1)+2×(-393.5kJmol-1)+870.3kJmol-1=-488.3KJmol-1;
(3)①在乙酸和乙酸钠按一定比例混合可制成的缓冲溶液中,既存在醋酸的电离,又存在醋酸根离子的水解,当溶液中OH-浓度增大时,发生CH3COOH+OH-=CH3COO-+H2O,降低增加的OH-浓度,这就是该缓冲溶液能治疗碱中毒的原因;
②已知CH3COOH![]() CH3COO-+H+,Ka=
CH3COO-+H+,Ka= =
=![]() =1.7×10-5;设向该溶液中加入nmolCH3COONa可使溶液的pH约为4,此时c(H+)=10-4mol/L,c(CH3COO-)=n mol/L,c(CH3COOH)=0.1mol/L,温度不变,电离平衡常数不变,即
=1.7×10-5;设向该溶液中加入nmolCH3COONa可使溶液的pH约为4,此时c(H+)=10-4mol/L,c(CH3COO-)=n mol/L,c(CH3COOH)=0.1mol/L,温度不变,电离平衡常数不变,即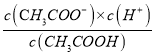 =1.7×10-5=
=1.7×10-5=![]() ,解得n=1.7×10-2mol;
,解得n=1.7×10-2mol;
(4)①由图示可知,温度升高![]() 减小,总物质的量增大,即平衡正向移动,△H>0,因升温平衡正向移动,反应限度越大,即b点平衡常数最大;
减小,总物质的量增大,即平衡正向移动,△H>0,因升温平衡正向移动,反应限度越大,即b点平衡常数最大;
②反应正方向为体积增大的方向,吸热反应,则由图示可知测定乙酸的摩尔质量应选择的适宜条件是低压、高温。


科目:高中化学 来源: 题型:
【题目】部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
下列说法正确的是

A. V=448 B. 样品中CuO的质量为4.0 g
C. 滤液A中的阳离子为Fe2+、Fe3+、H+ D. 样品中Fe元素的质量为2.14 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝合金粉末10.2g溶于500mL 4mol·L-1盐酸中恰好完全反应。若加入2mol·L-1的氢氧化钠溶液,使得沉淀达到最大量,则需加入氢氧化钠溶液的体积为
A. 100mL B. 500mL C. 1000mL D. 1500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3、CuCl2和HCl的混合溶液中加入铁粉,待反应结束后,将剩余的固体滤出,发现固体能被磁铁吸引,则反应后溶液中大量存在的阳离子是
A.Fe2+ B.H+ C.Cu2+和Fe2+ D.Fe3+和Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得
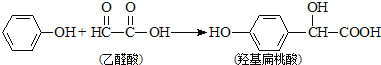
下列有关说法正确的是
A. 苯酚和羟基扁桃酸互为同系物
B. 标准状况下,22.4L羟基扁桃酸中共用电子对的数目为24NA
C. 乙醛酸只存在一种不同环境的氢原子
D. 羟基扁桃酸分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为
可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为![]() 。工业上常采用如图所示的电解装置,通电电解,然后通入
。工业上常采用如图所示的电解装置,通电电解,然后通入![]() 加以处理。下列说法不正确的是 ( )
加以处理。下列说法不正确的是 ( )

A. 电解时阳极反应式为![]() ]
]
B. 电解时阴极反应式为![]()
C. 当电解过程中有标准状况下 22. 4L 的![]() 生成时,溶液中有 32g S析出(溶解忽略不计)
生成时,溶液中有 32g S析出(溶解忽略不计)
D. 整个过程中需要不断补充![]() 与
与![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如下。下列说法正确的是( )

A.若a点pH=4,且c(Cl-)=m c(ClO-),则Ka(HClO)=![]()
B.若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中:c(OH-)—c(H+)=2c(Cl-)+c(HClO)
D.b~c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com