
对于可逆反应A(g)+3B(s)2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
A.v(A)=0.5 mol·L-1·min-1
B.v(B)=1.2 mol·L-1·s-1
C.v(D)=0.4 mol·L-1·min-1
D.v(C)=0.1 mol·L-1·s-1
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并积极采取措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是__________(填字母)。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫化物沉降 | 化学法 |
| C | 含纯碱的废水 | 加石灰水反应 | 化学法 |
(2)下图是某市污水处理的工艺流程示意图:
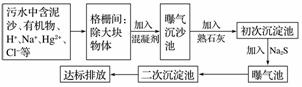
①下列物质中不可以作为混凝剂(沉降剂)使用的是____(填字母)。
A.偏铝酸钠 B.氧化铝
C.碱式氯化铝 D.氯化铁
②混凝剂除去悬浮物质的过程是________(填字母)。
A.物理变化 B.化学变化
C.既有物理变化又有化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产纯碱的工艺流程示意图如下:
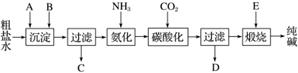
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式:A________,B________。
(2)实验室提纯粗盐的实验操作依次为取样、________、沉淀、________、________、冷却结晶、________、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是_______________________
________________________________________________________________________。
碳酸化时没有析出碳酸钠晶体,其原因是__________________________________________
________________________________________________________________________。
(4)碳酸化后过滤,滤液D最主要的成分是______________________(填写化学式),检验这一成分的阴离子的具体方法是:_____________________________________________。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水时所发生的反应的离子方程式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠。
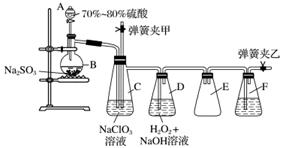
装置C中发生反应:2NaClO3+SO2===2ClO2+Na2SO4(Ⅰ)
装置D中发生反应:2ClO2+H2O2+2NaOH===2NaClO2+2H2O+O2(Ⅱ)
(1)仪器组装完毕,关闭两个弹簧夹,打开A中活塞,向A中注入水可检验装置气密性,装置气密性良好的现象是________________________。实验开始时,打开A的活塞,两个弹簧夹的开关操作是__________________,F中盛有的液体为________。
(2)装置B中进行的是用硫酸与亚硫酸钠制备二氧化硫的反应,该处使用的是70%~80%的硫酸,而不是98%的浓硫酸或极稀的硫酸,原因是___________________________________。
(3)装置C的作用是________________,装置E的作用是________________。
(4)在碱性溶液中NaClO2比较稳定,所以装置D中应维持NaOH稍过量,判断NaOH是否过量所需要的试剂是________。
a.稀盐酸 b.品红溶液 c.石蕊溶液 d.酚酞溶液
(5)一次实验制备中,通过检验发现制备的NaClO2中含有NaOH、Na2SO3,出现这些杂质的可能原因是__________________。检验产物中含有Na2SO3杂质的实验操作和现象是________________________________________________________________________。
(供选择的试剂有:Ba(OH)2溶液、H2O2溶液、AgNO3溶液、品红溶液、H2SO4溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+H2O,下列各组实验中最先出现浑浊的是( )
| 选项 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,N2O分解的部分实验数据如下:
| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(N2O)/mol·L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 |
| 反应时间/min | 60 | 70 | 80 | 90 | 100 | |
| c(N2O)/mol·L-1 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
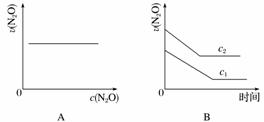
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
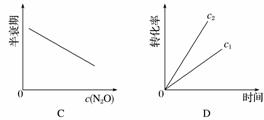
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L的恒容密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
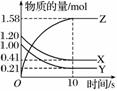
(1)从反应开始到10 s时,用Z表示的反应速率为__________,X的物质的量浓度减少了________,Y的转化率为______。
(2)该反应的化学方程式为______________________________________。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示。则下列说法符合该图像的是______。
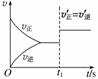
A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
| 温度(℃) | c(NH3·H2O) (mol·L-1) | 电离常数 | 电离度(%) | c(OH-) (mol·L-1) |
| 0 | 16.56 | 1.37×10-5 | 9.098 | 1.507×10-2 |
| 10 | 15.16 | 1.57×10-5 | 10.18 | 1.543×10-2 |
| 20 | 13.63 | 1.71×10-5 | 11.2 | 1.527×10-2 |
提示:电离度=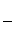 ×100%
×100%
(1)温度升高,NH3·H2O的电离平衡向________(填“左”或“右”)移动,能支持该结论的表中数据是______(填字母)。
a.电离常数 b.电离度
c.c(OH-) d.c(NH3·H2O)
(2)表中c(OH-)基本不变的原因是______________________________________。
(3)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是______(填字母,下同)。
A.溶液的pH增大 B.氨水的电离度减小
C.c(OH-)减小 D.c(NH )减小
)减小
(4)将氨水与盐酸等浓度等体积混合,下列做法能使c(NH )与c(Cl-)比值变大的是______。
)与c(Cl-)比值变大的是______。
A.加入固体氯化铵 B.通入少量氯化氢
C.降低溶液温度 D.加入少量固体氢氧化钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com