
| A. | 钠-钾合金可在核反应堆中用作热交换液 | |
| B. | 过氧化钠可用作潜水艇中的供氧剂 | |
| C. | 纯碱可用作治疗胃酸过多的药剂 | |
| D. | 碳酸氢钠溶液用于制泡沫灭火剂 |
分析 A.钠-钾合金具有良好的导热性;
B.过氧化钠可与二氧化碳反应生成氧气;
C.纯碱具有较强的腐蚀性;
D.碳酸氢钠可与硫酸铝发生互促水解反应生成二氧化碳气体.
解答 解:A.钠-钾合金可在核反应堆中用作热交换液,原因是具有良好的导热性,故A正确;
B.过氧化钠可与二氧化碳反应生成氧气,可用作潜水艇中的供氧剂,故B正确;
C.纯碱具有较强的腐蚀性,不能用作治疗胃酸过多的药剂,一般用碳酸氢钠、氢氧化铝等,故C错误;
D.碳酸氢钠可与硫酸铝发生互促水解反应生成二氧化碳气体,可用于制泡沫灭火剂,故D正确,
故选C.
点评 本题考查较为综合,涉及元素化合物的综合应用,为高频考点,有利于培养学生的良好的科学素养,提高学习的积极性,明确物质的性质是解本题关键,性质决定用途,根据碳酸钠、钠和过氧化钠、碳酸氢钠的性质来分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的有效成份是氯酸钙 | B. | 氟化氢溶于水形成的氢氟酸是强酸 | ||
| C. | 碘化钾水溶液能使淀粉变蓝 | D. | 氟气通入水中有氧气生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
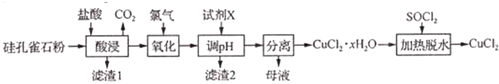
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
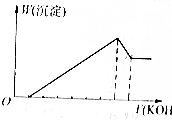 把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )
把镁铝合金用稀H2SO4溶液完全溶解后,在所得溶液中加入KOH溶液的体积与生成沉淀的质量关系如图所示,则合金中镁与铝的质量比是( )| A. | 1:1 | B. | 8:9 | C. | 4:3 | D. | 4:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、MnO4-、SO42- | B. | Na+、SiO32-、NO3-、CO32- | ||
| C. | Na+、NO3-、SO42-、HCO3- | D. | Mg2+、SO42-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
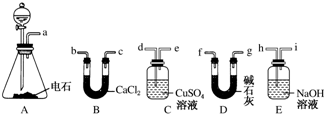
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8:3 | B. | 3:2 | C. | 1:3 | D. | 3:8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com