
【题目】铁、钴、镍及化合物在机械制造、磁性材料、新型电池或高效催化剂等许多领域都有着广泛的应用。请回答下列问题:
![]() 基态Ni原子的价电子排布式为_______。镍与CO生成的配合物
基态Ni原子的价电子排布式为_______。镍与CO生成的配合物![]() ,
,![]() 中含有的
中含有的![]() 键数目为_________;写出与CO互为等电子体的阴离子的化学式_________。
键数目为_________;写出与CO互为等电子体的阴离子的化学式_________。
![]() 研究发现,在
研究发现,在![]() 低压合成甲醇反应
低压合成甲醇反应![]() 中,Co氧化物负载的纳米粒子催化剂具有高活性,显示出良好的应用前景。
中,Co氧化物负载的纳米粒子催化剂具有高活性,显示出良好的应用前景。
![]() 元素Co与O中,第一电离能较大的是_______。
元素Co与O中,第一电离能较大的是_______。
![]() 生成物
生成物![]() 与
与![]() 中,沸点较高的是________,原因是___________。
中,沸点较高的是________,原因是___________。
![]() 用KCN处理含
用KCN处理含![]() 的盐溶液,有红色的
的盐溶液,有红色的![]() 析出,将它溶于过量的KCN溶液后,可生成紫色的
析出,将它溶于过量的KCN溶液后,可生成紫色的![]() 。
。![]() 具有强还原性,在加热时能与水反应生成淡黄色的
具有强还原性,在加热时能与水反应生成淡黄色的![]() ,写出该反应的离子方程式____________。
,写出该反应的离子方程式____________。
![]() 铁有
铁有![]() 、
、![]() 、
、![]() 三种同素异形体
三种同素异形体![]() 如图
如图![]() ,
,![]() 、
、![]() 两种晶胞中铁原子的配位数之比为_____。
两种晶胞中铁原子的配位数之比为_____。
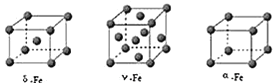
![]() 若Fe原子半径为rpm,
若Fe原子半径为rpm,![]() 表示阿伏加德罗常数的值,则
表示阿伏加德罗常数的值,则![]() 单质的密度为_______
单质的密度为_______![]() 列出算式即可
列出算式即可![]() 。
。
![]() 在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为
在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为![]() 1,
1,![]() 晶面。如图,则
晶面。如图,则![]() 晶胞体中
晶胞体中![]() 1,
1,![]() 晶面共有_____个。
晶面共有_____个。

【答案】![]()
![]()
![]() 或
或![]()
![]()
![]()
![]() 的沸点较高,因为平均一个水分子能形成两个氢键
的沸点较高,因为平均一个水分子能形成两个氢键![]() 而平均一个
而平均一个![]() 分子只能形成一个氢键,氯键越多,熔沸点越高。所以
分子只能形成一个氢键,氯键越多,熔沸点越高。所以![]() 沸点高
沸点高 ![]()
![]() :3
:3 ![]() 4
4
【解析】
(1)Co为27号元素,位于第四周期第ⅤⅢ族;1个Ni(CO)4中含有4个配位键、4个共价三键,每个共价三键中含有一个σ键,配位键也属于σ键;与CO互为等电子体的阴离子中含有2个原子、价电子数是10;
(2)①O元素是非金属,Co是金属元素;
②氢键越多,熔沸点越高;
③[Co(CN)6]4-配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,只能是水中氢元素被还原为氢气,根据电荷守恒有氢氧根离子生成;
(3)①δ晶胞为体心立方堆积,Fe原子配位数为8.a晶胞为简单立方堆积,Fe原子配位数为6;
②γ-Fe中顶点粒子占![]() ,面心粒子占
,面心粒子占![]() ,根据晶体密度ρ=
,根据晶体密度ρ=![]() 计算;
计算;
③在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为(1,1,1)晶面,该立方晶胞体中(1,1,1)晶面共有4个。
![]() 基态Ni原子的价电子为3d能级上的8个电子、4s能级上的2个电子,其价电子排布式为
基态Ni原子的价电子为3d能级上的8个电子、4s能级上的2个电子,其价电子排布式为![]() ;1个
;1个![]() 中含有4个配位键、4个共价三键,每个共价三键中含有一个
中含有4个配位键、4个共价三键,每个共价三键中含有一个![]() 键,配位键也属于
键,配位键也属于![]() 键,所以该分子中含有8个
键,所以该分子中含有8个![]() 键,则1mol该配合物中含有
键,则1mol该配合物中含有![]() 个
个![]() 键;与CO互为等电子体的阴离子中含有2个原子、价电子数是10,符合条件的阴离子为
键;与CO互为等电子体的阴离子中含有2个原子、价电子数是10,符合条件的阴离子为![]() 或
或![]() ;
;
![]() 元素Co与O中,由于O元素是非金属而Co是金属元素,O比Co原子更难失去电子,所以第一电离能较大的是O;
元素Co与O中,由于O元素是非金属而Co是金属元素,O比Co原子更难失去电子,所以第一电离能较大的是O;
![]() 与
与![]() 均为极性分子,
均为极性分子,![]() 中氢键比甲醇多。沸点从高到低的顺序为
中氢键比甲醇多。沸点从高到低的顺序为![]() ;具体地说,
;具体地说,![]() 的沸点较高,是因为平均一个水分子能形成两个氢键
的沸点较高,是因为平均一个水分子能形成两个氢键![]() 而平均一个
而平均一个![]() 分子只能形成一个氢键,氯键越多,熔沸点越高;所以
分子只能形成一个氢键,氯键越多,熔沸点越高;所以![]() 沸点高;
沸点高;
![]() 配离子具有强还原性,在加热时能与水反应生成淡黄色
配离子具有强还原性,在加热时能与水反应生成淡黄色![]() ,只能是水中氢元素被还原为氢气,根据电荷守恒有氢氧根离子生成,该反应离子方程式为:
,只能是水中氢元素被还原为氢气,根据电荷守恒有氢氧根离子生成,该反应离子方程式为:![]()
![]() ;
;
![]() 晶胞为体心立方堆积,Fe原子配位数为8;a晶胞为简单立方堆积,Fe原子配位数为6,则
晶胞为体心立方堆积,Fe原子配位数为8;a晶胞为简单立方堆积,Fe原子配位数为6,则![]() 、a两种晶胞中铁原子的配位数之比为8:
、a两种晶胞中铁原子的配位数之比为8:![]() :3;
:3;
![]() 中顶点粒子占
中顶点粒子占![]() ,面心粒子占
,面心粒子占![]() ,则一个晶胞中含有Fe的个数为
,则一个晶胞中含有Fe的个数为![]() 个,不妨取1mol这样的晶胞,即有
个,不妨取1mol这样的晶胞,即有![]() 个这样的晶胞,1mol晶胞的质量为
个这样的晶胞,1mol晶胞的质量为![]() ,根据立体几何知识,晶胞边长a与Fe的半径的关系为
,根据立体几何知识,晶胞边长a与Fe的半径的关系为![]() ,所以
,所以![]() ,则一个晶胞体积为
,则一个晶胞体积为![]() ,所以晶体密度为:
,所以晶体密度为:![]() ;
;
![]() 观察图可得在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为
观察图可得在立方晶胞中与晶胞体对角线垂直的面在晶体学中称为![]() 1,
1,![]() 晶面,该立方晶胞体中
晶面,该立方晶胞体中![]() 1,
1,![]() 晶面共有4个。
晶面共有4个。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在研究金矿床物质组分的过程中,通过分析发现了![]() 多金属互化物.
多金属互化物.
![]() 某金属互化物属于晶体,区别晶体和非晶体可通过 ______ 方法鉴别.该金属互化物原子在三维空间里呈周期性有序排列,即晶体具有 ______ 性.
某金属互化物属于晶体,区别晶体和非晶体可通过 ______ 方法鉴别.该金属互化物原子在三维空间里呈周期性有序排列,即晶体具有 ______ 性.
![]() 基态
基态![]() 的核外电子排布式 ______ ;配合物
的核外电子排布式 ______ ;配合物![]() 常温下为液态,易溶于
常温下为液态,易溶于![]() 、苯等有机溶剂.固态
、苯等有机溶剂.固态![]() 属于 ______ 晶体.
属于 ______ 晶体.
![]() 铜能与类卤素
铜能与类卤素![]() 反应生成
反应生成![]() 分子中含有
分子中含有![]() 键的数目为 ______ ;
键的数目为 ______ ;
类卤素![]() 对应的酸有两种,理论上硫氰酸
对应的酸有两种,理论上硫氰酸![]() 的沸点低于异硫氰酸
的沸点低于异硫氰酸![]() 的沸点,其原因是 ______ ;
的沸点,其原因是 ______ ;
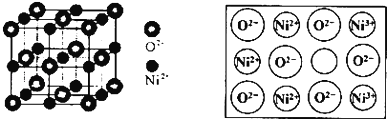
![]() 立方
立方![]() 氧化镍
氧化镍![]() 晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为 ______
晶体的结构如图所示,其晶胞边长为apm,列式表示NiO晶体的密度为 ______ ![]() 不必计算出结果,阿伏加德罗常数的值为
不必计算出结果,阿伏加德罗常数的值为![]() 人工制备的NiO晶体中常存在缺陷
人工制备的NiO晶体中常存在缺陷![]() 如图 一个
如图 一个![]() 空缺,另有两个
空缺,另有两个![]() 被两个
被两个![]() 所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.已知某氧化镍样品组成
所取代,其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化.已知某氧化镍样品组成![]() ,该晶体中
,该晶体中![]() 与
与![]() 的离子个数之比为 ______ .
的离子个数之比为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡:K2SO4·MgSO4·2CaSO4 (s)![]() 2Ca2++2K++Mg2++4SO42-。不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是
2Ca2++2K++Mg2++4SO42-。不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是

A.该平衡的Ksp=c2(Ca2+)·c2(K+)·c(Mg2+)·c4(SO42-)B.向该体系中加入饱和K2SO4溶液,溶解平衡向左移动 C.升高温度,溶浸速率增大,平衡向正反应方向移动 D.向该体系中加入饱和NaOH溶液,溶解平衡不发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定环境中能大量共存的是( )
A.在 =1013的溶液中:NH4+、Ca2+、Cl-、K+
=1013的溶液中:NH4+、Ca2+、Cl-、K+
B.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、HCO3-、Cl-、K+
C.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子能大量共存的是( )
A. 稀硫酸中:K+、Mg2+、A1O2-、S2O32-
B. KW/c(H+)=10-13 mol·L-1 的溶液中:Fe3+、NH4+、Mg2+、SO42-
C. 使甲基橙变红的溶液中:Fe2+、MnO4﹣、Na+、SO42﹣
D. 通入大量 CO2 的溶液中:Na+、ClO-、CH3COO-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色溶液中:Al3+、NH4+、Cl-、S2-
B.使酚酞显红色的溶液中:Na+、ClO-、CO32-、NO3-
C.0.1mol·L-1FeCl3溶液中:Mg2+、NH4+、SCN-、SO42-
D.由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Fe2+、Cu2+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄素M是拟交感神经药。合成M的一种路线如图所示:

已知:Ⅰ.芳香烃A的相对分子质量为92
Ⅱ.R—CH2OH![]() RCHO
RCHO
III.R1-CHO+
IV.
V.
请回答下列问题:
(1)D的名称是_______;G中含氧官能团的名称是_______。
(2)反应②的反应类型为_______;A的结构简式为_______。
(3)写出反应⑦的化学方程式:______________________________。
(4)X分子中最多有_______个碳原子共平面。
(5)在H的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式为_________________。
(6)已知:![]() 仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体
仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体![]() 的路线________________。
的路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种,离子浓度都为
中的若干种,离子浓度都为![]() 往该溶液中加入过量的
往该溶液中加入过量的![]() 和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:
和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:

则关于原溶液的判断中正确的是![]()
A.无法确定原溶液中是否存在![]()
B.肯定存在的离子是![]() 、
、![]() ,是否存在
,是否存在![]() 、
、![]() 需要通过焰色反应来确定
需要通过焰色反应来确定
C.肯定不存在的离子是![]() 、
、![]() 、
、![]() ,是否含
,是否含![]() 另需实验验证
另需实验验证
D.若步骤中![]() 和
和![]() 溶液改用
溶液改用![]() 和盐酸的混合溶液,则对溶液中离子的判断无影响
和盐酸的混合溶液,则对溶液中离子的判断无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料E和含扑热息痛高分子药物的合成流程如下图所示:

已知:I.含扑热息痛高分子药物的结构为: 。
。
II.![]()
III.![]()
试回答下列问题:
(1)①的反应类型为____________,G的分子式为____________。
(2)若1 mol 可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式_____________。
可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式_____________。
(3)反应②为加成反应,则B的结构简式为__________;扑热息痛的结构简式为______________。
(4)写出含扑热息痛高分子药物与足量氢氧化钠溶液发生反应的化学方程式____________________。
(5)D蒸气密度是相同状态下甲烷密度的6.25倍,D中各元素的质量分数分别为碳60%,氢8%,氧32% 。D有多种同分异构体,其中属于链状酯类,且能发生银镜反应的同分异构体有_______种(考虑顺反异构)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com