
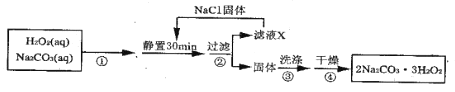
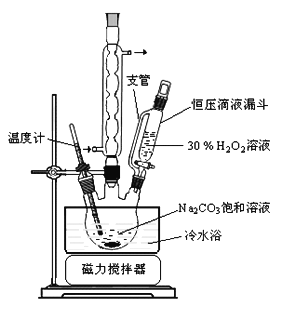
【题目】过碳酸钠(![]() )是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
已知主反应:![]()
![]()
![]() H<0
H<0
副反应:![]() 50℃时
50℃时![]() 开始分解
开始分解
请回答下列问题:
(1)步骤①的关键是_____________,其原因是______________________。
(2)在滤液X中加入适量NaCl固体的目的是________________________。
(3)步骤③中选用无水乙醇洗涤产品的目的是_______________________。
(4)下列物质中,会引起过碳酸钠失效的有____________。
A.![]() B.
B.![]() C.
C.![]() D.HCl
D.HCl
(5)过碳酸钠的产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶液→加入![]() 溶液→过滤→洗涤→干燥→称重。需直接测定的物理量有:样品的质量
溶液→过滤→洗涤→干燥→称重。需直接测定的物理量有:样品的质量![]() g,沉淀的质量
g,沉淀的质量![]() g,则产品中过碳酸钠质量分数的表达式为:___________。
g,则产品中过碳酸钠质量分数的表达式为:___________。
【答案】 控制反应温度不能超过50℃ 制备过碳酸钠是放热反应,防止H2O2和过碳酸钠分解 增大钠离子浓度,有利于过碳酸钠的析出,提高产率,减少损失 减少过碳酸钠的溶解损失,并带走水分利于干燥 BD 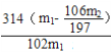
【解析】试题分析:本题考查过碳酸钠的制备实验,涉及实验条件的控制和实验试剂的作用,过碳酸钠的性质,定量实验的计算。
(1)根据题给已知:Na2CO3与H2O2生成过碳酸钠的反应为放热反应,H2O2会发生分解反应,50℃时2Na2CO3·3H2O2(s)开始分解,所以步骤①的关键是控制反应温度不能超过50℃,原因是制备过碳酸钠是放热反应,防止H2O2和过碳酸钠分解。
(2)在滤液X中加入适量NaCl固体的目的是:NaCl电离出Na+,增大Na+浓度,降低过碳酸钠的溶解度(盐析作用),有利于过碳酸钠析出,提高过碳酸钠的产率,减少损失。
(3)由于乙醇与水互溶,乙醇沸点低易挥发,过碳酸钠在乙醇中溶解度小,步骤③选用无水乙醇洗涤产品的目的是:减少过碳酸钠的溶解损失,带走水分,利于干燥。
(4)A,NaHCO3与过碳酸钠不反应,不会引起过碳酸钠失效;B,Na2SO3具有还原性,过碳酸钠具有氧化性,发生反应3Na2SO3+2Na2CO3·3H2O2=3Na2SO4+2Na2CO3+3H2O,会引起过碳酸钠失效;C,Na2SiO3与过碳酸钠不反应,不会引起过碳酸钠失效;D,HCl与过碳酸钠发生反应,引起过碳酸钠失效;会引起过碳酸钠失效的是Na2SO3、HCl,答案选BD。
(5)n(BaCO3)总=![]() mol,则n(Na2CO3)总=
mol,则n(Na2CO3)总=![]() mol,m(Na2CO3)总=
mol,m(Na2CO3)总=![]() mol
mol![]() 106g/mol=
106g/mol=![]() g,m(H2O2)=(m1-
g,m(H2O2)=(m1-![]() )g,n(H2O2)=(m1-
)g,n(H2O2)=(m1-![]() )g
)g![]() 34g/mol=
34g/mol= mol;n(2Na2CO3·3H2O2)=
mol;n(2Na2CO3·3H2O2)=![]() n(H2O2)=
n(H2O2)=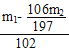 mol,m(2Na2CO3·3H2O2)= n(2Na2CO3·3H2O2)
mol,m(2Na2CO3·3H2O2)= n(2Na2CO3·3H2O2)![]() 314g/mol=
314g/mol=g,产品中过碳酸钠的质量分数为
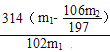 。
。


科目:高中化学 来源: 题型:
【题目】结合元素周期表回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。
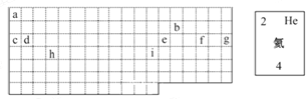
(2)表中所列元素,属于短周期元素的有_______,属于主族元素的有_______;g元素位于第_______周期________族;i元素位于第_______周期__________族。
(3)元素f是第_________周期、第_________族元素,请在右边方框中按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量。

(4)元素在元素周期表中的位置与元素原子结构的关系__________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组探究实验室中制备Cl2的过程,为证明过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如下图所示的实验装置,按要求回答问题。

(1)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是________________________。
(2)①装置B中盛放的试剂名称为_______,作用是___________,现象是___________。
②装置D和E中出现的不同现象说明的问题是_______________________________。
③装置F的作用是____________________。
④写出装置G中发生反应的离子方程式:__________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在________与________之间(填装置字母序号),装置中应加入________(填写试剂或用品名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和得出的结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向某溶液中滴入几滴酸性KMnO4溶液,然后滴加KSCN溶液 | 溶液最终变为红色 | 原溶液中含有 |
B | 向浓度均为0.1mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 |
|
C | 用洁净的铂丝蘸取某溶液,在酒精灯火焰上灼烧 | 透过蓝色钴玻璃观察到火焰焰色为紫色 | 原溶液中一定只含 |
D | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热煮沸 | 未见砖红色沉淀生成 | 淀粉未发生水解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电反应方程式为4Na+3CO2 =2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中错误的是( )

A. 电流流向为:MWCNT→导线→钠箔
B. 放电时,正极的电极反应式为 3CO2+4Na++4e-===2Na2CO3+C
C. 原两电极质量相等,若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为11.2g
D. 选用髙氯酸钠-四甘醇二甲醚做电解液的优点是导电性好,与金属钠不反应,难挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修:有机化学基础】
聚芳脂(PAP)是分子主链上带有苯环和脂基的特种工程塑料,在航空航天等领域具有广泛应用。下图是利用乙酰丙酸(CH2COCH2CH2COOH)合成聚芳脂E的路线:
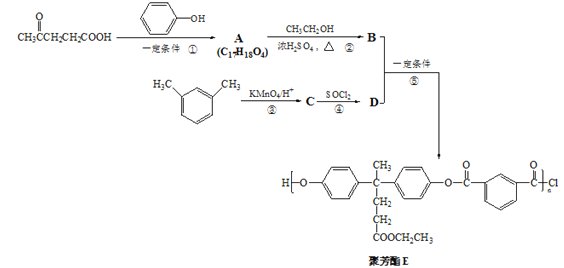
已知:I. ![]()
II. ![]() (R、R′表示烃基)
(R、R′表示烃基)
(1)乙酰丙酸中含有的官能团名称为_____________。
(2)B的分子式为_________________,D的结构简式为___________。
(3)反应②的化学反应方程式为______________,反应类型为_______________。
(4)反应⑤的化学反应方程式为______________,反应类型为_______________。
(5)符合下列条件的C的同分异构体有________种。
a.能发生银镜反应 b.能与NaHCO3溶液反应
c.分子中有苯环,无![]() 结构
结构
在上述同分异构体中,有一种苯环上有两个取代基且核磁共振氢谱图有4组峰的物质,写出该物质与足量NaOH溶液共热反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
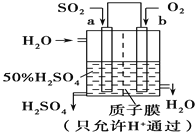
【题目】(1)氢氧燃料电池是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)燃料电池。如果是酸性燃料电池,则正极反应方程式是____________。
(2)科研人员设想用如图原电池装置生产硫酸,则负极的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A. CO2的电子式:![]() B. 质量数为37的氯原子:
B. 质量数为37的氯原子:![]() l
l
C. NH4Cl的电子式:![]() D. 原子核内有10个中子的氧原子:
D. 原子核内有10个中子的氧原子:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组查阅资料知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应。他们设计了下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中。
如图是制取溴苯的装置。试回答:
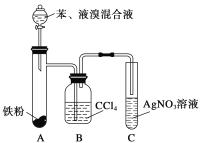
(1)装置A中发生反应的化学方程式是_________________________。
(2)装置C中看到的现象是____________________,证明________________________。
(3)装置B是吸收瓶,内盛CCl4液体,实验中观察到的现象是________,原因是____________。
如果没有B装置而将A、C直接相连,你认为是否妥当?________(填“是”或“否”),理由是______________________。
(4)实验完毕后将A试管中的液体倒在装有冷水的烧杯中,烧杯______________(填“上”或“下”)层为溴苯,这说明溴苯______________且______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com