
【题目】下列物质中,工业上常用电解法冶炼的是( )
A.FeB.NaC.CuD.Ag
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列大小比较正确的是
A. 等体积、等物质的量浓度的NaCl(aq)离子总数小于NaClO(aq)中离子总数
B. 25 ℃时,pH=3的硫酸溶液中水的电离程度大于pH=11的氨水中水的电离程度
C. 0.1 mol·L-1(NH4)2CO3溶液中的c(NH![]() )大于0.1 mol·L-1的NH4Cl溶液中的c(NH
)大于0.1 mol·L-1的NH4Cl溶液中的c(NH![]() )的2倍
)的2倍
D. 常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,溶液中c(Na+)大于c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 25℃时 Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
B. 常温下,NaClO溶液显碱性的原因:ClO—+ H2O =" HClO" + OH—
C. 2NO(g) + 2CO(g) = N2(g) + 2CO2(g),在常温下能自发进行,则该反应的△H >0
D. 25℃时向水中加入少量NaOH后,由水电离出的c(H+)c(OH—)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( )
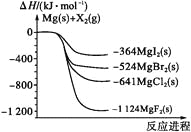
A. 由MgCl2制取Mg是放热过程
B. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
C. 常温下氧化性:F2<Cl2<Br2<I2
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s) + Cl2(g) ═ MgCl2(s) + Br2(g) △H = -117kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。该电池工作时的总反应为:NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法正确的是
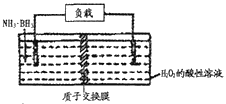
A. 正极附近溶液的pH减小
B. 电池工作时,H+通过质子交换膜向负极移动
C. 消耗3.1g氨硼烷,理论上通过内电路的电子为0.6ml
D. 负极电极反应为:NH3·BH3+2H2O-6e-= NH4++BO2-+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分含Fe元素的徽粒在溶液中的物质的量分数与溶液pH的关系如图所示,下列说法正确的是

A. HFeO4-在水中的电离程度小于水解程度
B. B、C两点对应溶液中水的电离程度:B > C
C. B点溶液加适里水稀释,溶液中所有离子浓度均减小
D. 由A点数据可知,H2FeO4的第一步电离平衡常数Ka1=4.15×l0-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以2氯丙烷为主要原料制1,2丙二醇[CH3CH(OH)CH2OH]时,依次经过的反应类型为( )
A. 加成反应→消去反应→取代反应
B. 消去反应→加成反应→取代反应
C. 消去反应→取代反应→加成反应
D. 取代反应→加成反应→消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中的NO、NO2进入大气后,会形成光化学烟雾、破坏臭氧层等。可用氢氧化钠溶液对含氮氧化物的废气进行处理,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。氨气也可以用来处理氮氧化物。例如,氨气与一氧化氮可发生如下反应:4NH3+6NO=5N2+6H2O。将一定量NO和NO2的混合气体通入300mL5mol/LNaOH溶液中,恰好被完全吸收。下列说法不正确的是
A. 若用氨气处理,所需氨气在标准状况下的体积可能为22.4 L
B. 所得溶液中NaNO3和NaNO2的物质的量之比可能为1:2
C. 原混合气体中NO在标准状况下的体积可能为16. 8 L
D. 在用氨气处理氮氧化物时,氮氧化物发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:

请回答下列问题:
(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是__________________________________。
(2)“合成”阶段生成Na2FeO4的离子方程式为__________________________________。
(3)为了检验“氧化”过程中所得FeCl3溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______(填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液
若选用酸性K MnO4溶液进行检验,请分析方案是否合理,并说明理由:_____________________________。
(4)过程①制取FeCl3固体的具体操作步骤是_____________________________________________________。若使6.4mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH小于_______{已知该实验条件下,Ksp[(Fe(OH)3]=8.5×10-36,Kw=1.1×10-13,1.13≈1.33}
(5)在不同温度和不同pH下,FeO42-的稳定性如下图所示:

从上图分析,为了提高“合成”阶段Na2FeO4的产率,可采取的实验条件范围为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com