
【题目】化学肥料在农业生产中有重要作用。农业生产中,大量施用的化肥主要是氮肥、磷肥、钾肥。
(1)普钙是磷肥,它的有效成分是________(写化学式)。
(2)尿素是一种含氮量较高的氮肥,工业生产尿素是将氨气与二氧化碳在加压、加热的条件下反应生成氨基甲酸铵(H2NCOONH4),再使氨基甲酸铵脱水得到尿素。反应的化学方程式为______________、______________。
(3)农谚说的“粪和肥,肥料飞”指的是粪尿与草木灰搅和在一起会降低肥效。请你说明其中的化学原理:________________________。
(4)合成氨是生产氮肥的重要环节。合成氨生产简易流程示意图如下:

从示意图可知其存在循环操作。简要说明为什么在化工生产中经常采用循环操作?______。
【答案】Ca(H2PO4)2·H2O 2NH3+CO2![]() H2NCOONH4 H2NCOONH4
H2NCOONH4 H2NCOONH4![]() H2NCONH2+H2O 粪尿最终转化为铵盐,而草木灰的有效成分为K2CO3,K2CO3受潮后水解为KOH,显碱性,NH4+与OH-可发生反应生成NH3逸出而降低肥效 从原因来讲,许多化学反应是可逆反应,转化率低;从结果来说,循环操作的主要目的在于充分利用原料、降低成本;从工艺设计来说,循环操作有利于连续化生产、减少工序;从环保角度来说,实现全封闭生产,控制废弃物排放
H2NCONH2+H2O 粪尿最终转化为铵盐,而草木灰的有效成分为K2CO3,K2CO3受潮后水解为KOH,显碱性,NH4+与OH-可发生反应生成NH3逸出而降低肥效 从原因来讲,许多化学反应是可逆反应,转化率低;从结果来说,循环操作的主要目的在于充分利用原料、降低成本;从工艺设计来说,循环操作有利于连续化生产、减少工序;从环保角度来说,实现全封闭生产,控制废弃物排放
【解析】
(1)普钙的有效成分是磷酸二氢钙;
(2)氨气和二氧化碳在加压、加热条件下反应生成氨基甲酸铵,氨基甲酸铵脱水生成尿素和水;
(3)农谚说的“粪和肥,肥料飞”指的是粪尿与草木灰搅和在一起会降低肥效,粪尿最终转化为铵盐,而草木灰的有效成分为K2CO3,K2CO3受潮后水解为KOH,显碱性,NH4+与OH-可发生反应生成NH3逸出而降低肥效;
(4)可从生产成本(原料的利用率)、生产原理、生产工艺以及环保等角度综合分析化工生产过程中设计循环操作的目的、作用。
(1)普钙的成分为Ca(H2PO4)2·H2O与CaSO4,其有效成分为Ca(H2PO4)2·H2O。故答案为:Ca(H2PO4)2·H2O;
(2)由题中信息,氨气和二氧化碳在加压、加热条件下反应生成氨基甲酸铵,氨基甲酸铵脱水生成尿素和水,利用原子守恒可直接写出反应的方程式:2NH3+CO2![]() H2NCOONH4,H2NCOONH4
H2NCOONH4,H2NCOONH4![]() H2NCONH2+H2O。故答案为:2NH3+CO2
H2NCONH2+H2O。故答案为:2NH3+CO2![]() H2NCOONH4,H2NCOONH4
H2NCOONH4,H2NCOONH4![]() H2NCONH2+H2O;
H2NCONH2+H2O;
(3)农谚说的“粪和肥,肥料飞”指的是粪尿与草木灰搅和在一起会降低肥效,粪尿最终转化为铵盐,而草木灰的有效成分为K2CO3,K2CO3受潮后水解为KOH,显碱性,NH4+与OH-可发生反应生成NH3逸出而降低肥效;故答案为:粪尿最终转化为铵盐,而草木灰的有效成分为K2CO3,K2CO3受潮后水解为KOH,显碱性,NH4+与OH-可发生反应生成NH3逸出而降低肥效;
(4)从反应特点来说,许多化学反应是可逆反应,转化率低;从能源利用及经济方法来说,循环操作的主要目的在于充分地利用原料、降低成本;从工艺流程来说,循环操作有利于连续化生产、减少工序;从环保角度来说,实现全封闭生产,控制废弃物的排放;
故答案为:从反应特点来说,许多化学反应是可逆反应,转化率低;从能源利用及经济方法来说,循环操作的主要目的在于充分地利用原料、降低成本;从工艺流程来说,循环操作有利于连续化生产、减少工序;从环保角度来说,实现全封闭生产,控制废弃物的排放。


科目:高中化学 来源: 题型:
【题目】用含锂废渣(主要金属元素的含量:Li~3.50%、Ni~6.55%、Ca~6.41%、Mg~13.24%)制备Li2CO3,并用其制备Li+电池的正极材料LiFePO4。部分工艺流程如下:
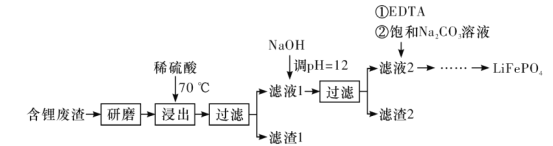
资料:i.滤液1、滤液2中部分离子的浓度(g·L-1):

ii.EDTA能和某些二价金属离子形成稳定的水溶性络合物。
iii.某些物质的溶解度(S)如下表所示:
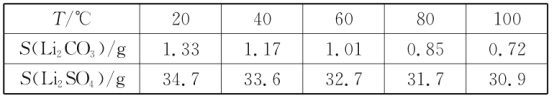
I.制备Li2CO3粗品
(1)上述流程中为加快化学反应速率而采取的措施是___。
(2)滤渣2的主要成分有___。
(3)向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90°C下充分反应后,分离出固体Li2CO3粗品的操作是__。
(4)处理1kg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是__g。
II.纯化Li2CO3粗品
(5)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是__,该池使用了__(填“阳”或“阴”)离子交换膜。

III.制备LiFePO4
(6)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组用如图装置制取、收集纯净干燥的氨气,并探究氨气的有关性质。
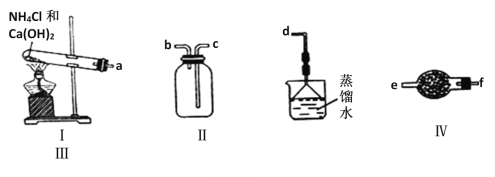
回答下列问题:
(1)开始实验之前要进行的操作是________________________________
(2)写出利用装置I制取氨气的化学方程式_____________________________。
(3)按照a、f、e、b、c、d的顺序将仪器连接,装置Ⅲ中倒置漏斗的作用是____________,装置IV中仪器的名称为_____________,盛装的试剂为_____________。
(4)向NH3的水溶液中滴加1~2滴酚酞溶液,溶液颜色由无色变________色,说明溶液显____性,写出其电离方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS)是炼铜的最主要矿物,在野外很容易被误会为黄金,又称愚人金。
(1)火法冶炼黄铜矿的过程中,利用了Cu2O与Cu2S反应生成Cu单质,反应的化学方程式是___。
(2)S位于周期表中___族,该族元素氢化物中,H2Te比H2S沸点高的原因是__。H2O比H2Te沸点高的原因是__。
(3)S有+4和+6两种价态的氧化物,回答下列问题:
①下列关于气态SO3和SO2的说法中,正确的是__(填字母代号)。
A.中心原子的价层电子对数目相等 B.都是极性分子
C.中心原子的孤电子对数目相等 D.都含有极性键
②将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图1,此固态SO3中S原子的杂化轨道类型是__。

(4)Cu有+1和+2两种价态的化合物,回答下列问题:
①Cu+的价电子排布图为___,Cu2+有__个未成对电子。
②新制的Cu(OH)2能够溶解于过量浓碱溶液中,反应的离子方程式是___。
(5)CuFeS2的晶细胞如图2所示,晶胞参数α=0.524nm,c=1.032nm;CuFeS2的晶胞中每个Cu原子与__个S原子相连,列式计算晶体密度ρ=__g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能在下列溶液中大量共存的离子组是( )
A. 常温下pH=7的溶液中:Fe3+、NO![]() 、Al3+、Cl-
、Al3+、Cl-
B. 水电离的c(H+)=1×10-13mol·L-1的溶液:Na+、NH4+、SO![]() 、CO
、CO![]()
C. 含有0.1mol·L-1Ca2+的溶液中:Na+、Cu2+、SiO![]() 、NO
、NO![]()
D. 含有大量NO![]() 的溶液:K+、Fe2+、SO
的溶液:K+、Fe2+、SO![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①③⑥⑦B.①④⑥⑦C.②③④⑦D.①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.60g二氧化硅晶体中含有2NA个硅氧键
B.18g氨基(—ND2)中含有的电子数为9NA
C.80 °C时,lLpH =1的硫酸溶液中,含有的OH—数目为10—13NA
D.氯碱工业中,导线上流过NA个电子,则阳极放出氯气11.2 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元弱酸H2A溶液,按下式发生电离:H2A![]() H++HA-、HA-
H++HA-、HA-![]() H++A2-,下列四种溶液中c(A2-)最大的是( )
H++A2-,下列四种溶液中c(A2-)最大的是( )
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的盐酸与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某种烃A对氢气的相对密度为36 ,该烃中碳氢两元素的质量比为5∶1,求:
①确定该烃的分子式____________
②如果该烃的一氯取代物有4种,写出该烃的结构简式_______________
③烃A可由另一种烃B通过加成反应而制得,则烃B的可能的是(任写一种可能的结构简式)_______________
(2)写出下列反应的化学方程式
①甲苯生成TNT_________________________________;
②丙烯与氯化氢的加成反应___________________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com